卤素原子结构及其性质的比较 知识点题库
H2+F2═2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2═2HCl | 光照或点燃发生反应 |
H2+Br2═2HBr | 加热至一定温度才能反应 |
H2+I2═2HI | 不断加热才能缓慢反应,生成的HI会分解 |
-
(1) 卤族元素位于周期表中的 族.
-
(2) 用电子式表示HCl的形成过程
-
(3) 依据上表,可以推测出:随着原子序数的递增, (填字母).
a.单质的熔沸点逐渐升高 b.元素的非金属性逐渐减弱
c.卤化氢的还原性依次减弱 d.卤化氢的稳定性依次减弱
-
(4) 不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近.写出BrCl和SO2在水溶液中发生反应的化学方程式
-
(1) 与氯元素同族的短周期元素的原子结构示意图为
-
(2) 能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号).
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
-
(3)
工业上,通过如下转化可制得KClO3晶体:NaCl溶液
 NaClO3溶液
NaClO3溶液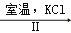 KClO3晶体
KClO3晶体①完成 I中反应的总化学方程式:
②II中反应过程能析出KClO3晶体而无其它晶体析出的原因是
-
(4) KClO3可用于实验室制O2 , 若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:
-
(5)
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 , 且
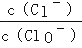 的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是
的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是 ①若某温度下,反应后
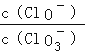 =11,则溶液中且且
=11,则溶液中且且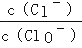 =
=
②参加反应的氯气的物质的量等于a mol
③改变温度,反应中转移电子的物质的量ne的范围:
 a mol≤ne≤
a mol≤ne≤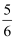 a mol
a mol④改变温度,产物中KClO3的最大理论产量为
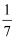 a mol.
a mol.
H2+F2═2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2═2HCl | 光照或点燃发生反应 |
H2+Br2═2HBr | 加热至一定温度才能反应 |
H2+I2═2HI | 不断加热才能缓慢反应,生成的HI会分解 |
-
(1) 卤族元素位于周期表中的族.
-
(2) 用电子式表示HCl的形成过程.
-
(3) 依据上表,可以推测出:随着原子序数的递增,(填字母).
a.单质的熔沸点逐渐升高 b.元素的非金属性逐渐减弱
c.卤化氢的还原性依次减弱 d.卤化氢的稳定性依次减弱
-
(4) 不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近.写出BrCl和SO2在水溶液中发生反应的化学方程式.
①随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易于氧气发生反应,加热时生成氧化物R2O
④砹是原子序数最大的卤族元素,根据卤素性质的递变规律,At与H2化合最容易
⑤从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳.
①2HClO4+Br2(g)═2HBrO4+Cl2
②2NaBr+Cl2═NaCl+Br2
③2KI+Cl2═2KCl+I2④2KI+Br2═2KBr+I2 .
①钾元素的焰色反应透过蓝色的钴玻璃观察呈紫色
②KI溶液中加入淀粉溶液会变成蓝色
③溴水中加入CCl4振荡静置后,CCl4层无色.
-
(1) 在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
-
(2) 已知在短周期主族元素中,元素a与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第周期族.
-
(3) 卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法错误的是 (填字母).A . 卤素单质的熔沸点按F2、Cl、Br2、I2的顺序由低到高 B . 原子半径按 C . Cl、Br、I的顺序由大到小 D . 卤化氢的稳定性按的H E . HCl、HBr、HI的顺序由强到弱 F . 卤素单质与氢气化合按的F2、Cl2、Br2、I2顺序由难变易
-
(4) 碘单质及其化合物具有重要应用.下列说法正确的是(填字母).
a.
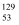 I与
I与 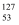 I互为同位素
I互为同位素b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
| 实验1 | 实验2 | 实验3 | |
| 装置 | | | |
| 现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是( )
-
(1) Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:

提高“反应1”反应速率的措施有(答出一条即可)。母液中溶质的主要成分是(填化学式)。
-
(2) 每有1mol SO2参加反应,理论上可生成ClO2的物质的量为mol。
-
(3) “反应2”的化学方程式为。
-
(4) 采取“减压蒸发”而不用“常压蒸发”,原因是。
-
(5) “反应2”中使用H2O2而不用其他物质的原因是。
-
(6) Ⅱ.亚氯酸钠的应用
用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是。
-
(7) 实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。写出上述反应的离子方程式为。
-
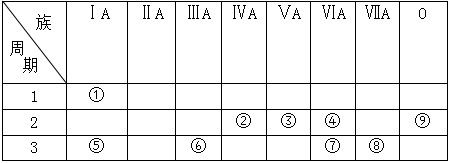
(1) 表中化学性质最不活泼的元素,其原子结构示意图为。
-
(2) ①分别与②、③、④形成的简单化合物中,最稳定的是
 填化学式
填化学式  。
。
-
(3) ③、④、⑤的原子半径由小到大的顺序为
 填元素符号
填元素符号  。
。
-
(4) ②、⑦、⑧的最高价氧化物对应水化物酸性由强到弱的顺序为
 填化学式
填化学式  。
。
-
(5) ⑤、⑧两元素形成的物质的电子式为。
-
(6) 表中最高价氧化物具有两性的元素是
 填序号
填序号  ,写出该元素的单质与⑤元素的最高价氧化物对应水化物的水溶液反应的离子方程式。
,写出该元素的单质与⑤元素的最高价氧化物对应水化物的水溶液反应的离子方程式。
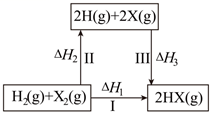

 B .
B .  C . 若X分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次增多
D . Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则
C . 若X分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次增多
D . Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则 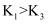
选项 | 操作和现象 | 结论 |
A | 向盛有Na2CO3固体的锥形瓶中滴加稀盐酸,产生无色气体 | 氯元素的非金属性强于碳元素 |
B | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物中一定含有乙烯 |
C | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀 | 蔗糖未水解 |