二氧化硫的性质 知识点题库
下列实验用来证明气体SO2的存在,其中正确的是( )
①能使品红溶液褪色
②能使湿润的蓝色石蕊试纸变红
③能使澄清的石灰水变浑浊
④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸
⑤通入到溴水使其褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成.
A . ①②④⑤
B . 都不能证明
C . ①⑤能证明
D . 只有⑤能证明
下列反应中,不能说明SO2是酸性氧化物的是( )
A . SO+H2O⇌H2SO3
B . SO2+2NaOH=Na2SO3+H2O
C . 2SO2+O2 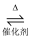 2SO3
D . SO2+CaO=CaSO3
2SO3
D . SO2+CaO=CaSO3
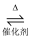 2SO3
D . SO2+CaO=CaSO3
2SO3
D . SO2+CaO=CaSO3
向CuSO4溶液中逐滴加KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.则下列分析中正确的是( )
A . 滴加KI溶液时,转移2mol e﹣时生成1mol白色沉淀
B . 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C . 通入SO2时,SO2与I2反应,I2作还原剂
D . 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
如图所示,夹子开始处于关闭状态,将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是( )
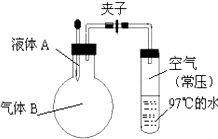
A . 水、氯化氢
B . 硫酸、氨气
C . 氢氧化钠溶液、二氧化硫
D . 氢氧化钠溶液、一氧化碳
SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
-
(1) 方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进水解(填离子符号,下同),二是沉淀一部分。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是(写化学式)。
③ 解吸:加热②中产物,产生SO2 , Al2(SO4)x(OH)y再生。
-
(2) 方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是。
-
(3) 方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2 , 滴入KSCN,颜色变红。
c.取b中溶液,。
-
(4) 方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
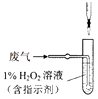
① H2O2氧化SO2的化学方程式。
② 废气中残留SO2的体积分数为。
一定条件下,CO与MgSO4反应会生成三种氧化物。某兴趣小组用如下装置探究该反应。已知:SO2与CO2通入澄清石灰水现象相同;SO2能使KMnO4溶液褪色。
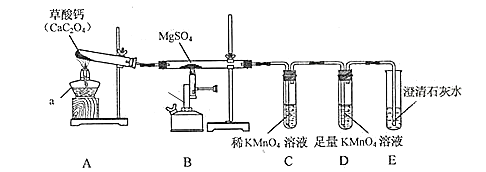
-
(1) 仪器 b 的名称是;CaC2O4 中 C 的化合价是。
-
(2) 连接好装置,开始实验前需要对上述装置进行的操作是。
-
(3) 装置 A 中充分反应后残留的固体是一种常见补钙剂的有效成分,则该化学方程式是。
-
(4) 实验时观察到装置 C 中紫红色褪去,装置 E 中溶液变浑浊,则装置 B 中反应的化学方程 式是;装置 D 的作用是。
-
(5) 该装置的不足之处是。
下列说法不正确的是()
A . 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B . SO2、氯气都能使品红溶液褪色,但原理不同
C . NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D . FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
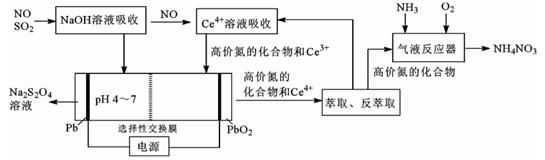
一种利用电化学方法同时脱除NO/SO2的工艺如图所示:
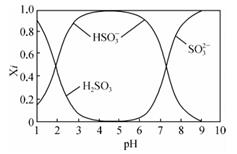
已知SO2水溶液中含硫微粒分布分数(Xi)与pH关系如图所示
-
(1) NaOH溶液吸收SO2时,溶液的pH由9→6时,主要发生反应的离子方程式为。
-
(2) 含Ce4+的溶液吸收NO,若高价氮中的NO2、N2O3、NO2-、NO3-各1mol,则消耗0.5mol·L-1的含Ce4+溶液的体积为L;其中NO转化NO3-的离子方程式为。
-
(3) 电解槽中,阴极电极反应式主要为,阳极电极反应式为。
-
(4) 在“气液反应器”中高价氮中的N2O3化合为NH4NO3的化学方程式为。
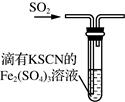
下列关于硫及其化合物的说法正确的是( )
A . 浓硫酸具有脱水性,可用于干燥氨气
B . 二氧化硫能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
C . 加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
D . 如图装置中血红色褪去,可以验证SO2的还原性
含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述错误的是( )
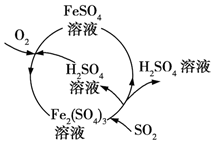
A . 该过程中可得到化工产品H2SO4
B . 该过程中化合价发生改变的元素为Fe和S
C . 该工艺流程是除去煤燃烧时产生的SO2
D . 图中涉及的反应之一为Fe2(SO4)3+SO2 + 2H2O=2FeSO4+2H2SO4
下列气体中,既不能用浓硫酸干燥,也不能用碱石灰干燥的是( )
A . NH3
B . H2S
C . SO2
D . H2
下列氧化物与盐酸或氢氧化钠溶液都不反应的是( )
A . CO
B . CO2
C . CaO
D . SO2
下列反应产生的气体,通入  溶液不反应的是( )
溶液不反应的是( )
 溶液不反应的是( )
溶液不反应的是( )
A .  和浓盐酸
B . Al与NaOH溶液
C . 浓硝酸和铜片
D . 铜片和浓硫酸共热
和浓盐酸
B . Al与NaOH溶液
C . 浓硝酸和铜片
D . 铜片和浓硫酸共热
 和浓盐酸
B . Al与NaOH溶液
C . 浓硝酸和铜片
D . 铜片和浓硫酸共热
和浓盐酸
B . Al与NaOH溶液
C . 浓硝酸和铜片
D . 铜片和浓硫酸共热
下列气体中,既能用浓硫酸干燥,又能用  固体干燥的是( )
固体干燥的是( )
 固体干燥的是( )
固体干燥的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
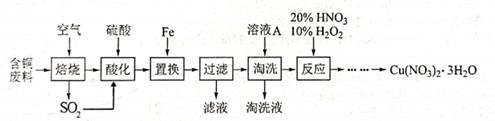
工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体的流程如图:
-
(1) 写出CuS“焙烧”生成SO2和CuO的化学反应方程式:。
-
(2) 图中SO2经转化生成的硫酸可用于“酸化”,转化反应中SO2与O2的物质的量比为。
-
(3) “过滤”后需洗涤沉淀,请设计实验证明已洗涤干净。
-
(4) “淘洗”所用的溶液A应选用(填序号)
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
-
(5) “反应”步骤加10% H2O2可以避免污染性气体的产生,写出该反应的离子方程式:,也可以用气体(填化学式)代替双氧水。
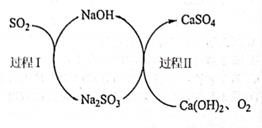
-
(6) 大量排放SO2容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气,过程如图所示,其中可循环使用的试剂是,写出双碱法脱硫法的总反应方程式:。
室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是( )
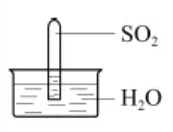
A . 试管内液面上升,证明SO2与水发生了反应
B . 试管中剩余少量气体,是因为SO2的溶解已达饱和
C . 取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3、H2SO3⇌H++  、
、  ⇌H++
⇌H++  D . 取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
D . 取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
 、
、  ⇌H++
⇌H++  D . 取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
D . 取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
保护环境,就是关爱自己.下列说法中你认为错误的是( )
A . 空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物
B . 酸雨属空气污染,是指pH小于7的雨水,主要是人为的向大气中排放大量酸性物质造成的
C . 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须回收处理
D . 氯气是一种黄绿色、有毒气体,但可以用于自来水的杀菌消毒
下列有关物质性质的叙述正确的是( )
A . 铜不能与浓硫酸发生反应
B . 氯水久置后,漂白性和酸性均增强
C . 二氧化硫能与高锰酸钾等强氧化剂反应
D . 二氧化硫与氯水混合使用漂白效果会更好
化学与社会发展密切相关。下列说法错误的是( )
A . 天然气是一种清洁的化石燃料
B . 绿色化学的核心是治理被污染的环境
C . 煤的干馏、石油裂化均属于化学变化
D . 燃煤中加入CaO可减少酸雨的形成
化学在生产、生活中有着广泛的应用,下列对应关系不正确的是( )
选项 | 化学性质 | 实际应用 |
A | 乙烯能与KMnO4溶液反应 | 用浸泡过KMnO4溶液的硅土保存水果 |
B | SO2具有还原性 | 用SO2漂白纸浆和草帽 |
C | FeCl3具有氧化性 | 用FeCl3溶液刻蚀铜制印刷电路板 |
D | 长链烷烃裂解可得短链烷烃和烯烃 | 用重油裂解制备有机化工原料 |
A . A
B . B
C . C
D . D
最近更新



