物质的量与其浓度和气体摩尔体积的综合应用 知识点题库
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol﹣1 . 若阿伏加德罗常数用NA表示,则:
-
(1) 该气体的物质的量为;
-
(2) 该气体所含原子总数为个;
-
(3) 该气体在标准状况下的体积为;
-
(4) 该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为.
设阿伏加德罗常数的值为NA , 标准状况下某种O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积(V)应是( )
A . 22.4nb/mNAL
B . 22.4mb/nNAL
C . 22.4nNA/mb L
D . nbNA/22.4m L
NA表示阿伏加德罗常数的值。下列说法正确的是( )
A . 32gO2中含有的电子数为16NA
B . 标准状况下,22.4 L H2O中含有的分子数为NA
C . 2.3g Na与100 mL 0.1mol·L-1盐酸反应,转移的电子数为0.01NA
D . 1L 1 mol·L-1 CaCl2溶液中含有的氯离子数为NA
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A . 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1 NA 个Fe3+
B . 1LpH=4的醋酸中有4NA个H+
C . 标准状况下,22.4L盐酸含有NA个HCl分子
D . 1mol NaHSO4溶于水,电离出的阳离子为2NA个
下列关于1.5mol氢气的叙述错误的是( )
A . 体积是33.6L
B . 质量是3g
C . 所含电子的物质的量是3mol
D . 氢原子数目约为3×6.02×1023个
钠,镁,铝,铁四种金属组成的混合物6 g,与足量的稀硫酸反应,产生标准状况下的氢气6.72 L,由此判断混合物中必含( )
A . 钠
B . 镁
C . 铝
D . 铁
下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H3PO4
A . ①④③②
B . ④③②①
C . ②③④①
D . ①④③②
下列叙述正确的是( )
A . 1mol任何气体的体积一定是22.4L
B . 标准状况下,22.4L的任何气体中都约含有6.02×1023个分子
C . 在标准状况下,体积为22.4L的物质都是1mol
D . 在非标准状况下,1mol任何气体的体积不可能是22.4L
设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A . 标准状况下,11.2LCCl4含有分子数为0.5NA
B . 常温常压下,56g丁烯(C4H8)中含有的共价单键总数为8NA
C . 56gFe溶于过量硝酸,电子转移数为2NA
D . 质量均为3.2g的S2、S4、S6中所含S原子数相等,都为0.1NA
标准状况下有:  甲烷、
甲烷、  个氯化氢分子、
个氯化氢分子、  克硫化氢、
克硫化氢、  摩尔氨气。下列对这四种气体的关系从小到大表示错误的是( )
摩尔氨气。下列对这四种气体的关系从小到大表示错误的是( )
 甲烷、
甲烷、  个氯化氢分子、
个氯化氢分子、  克硫化氢、
克硫化氢、  摩尔氨气。下列对这四种气体的关系从小到大表示错误的是( )
摩尔氨气。下列对这四种气体的关系从小到大表示错误的是( )
A . 体积:  B . 密度:
B . 密度:  C . 质量:
C . 质量:  D . 氢原子数:
D . 氢原子数: 
 B . 密度:
B . 密度:  C . 质量:
C . 质量:  D . 氢原子数:
D . 氢原子数: 
一定温度和压强下,用mg的H2、CH4、CO2、O2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是 ( )

A . 气球④中装的是CO2
B . 气球②和气球③中气体密度之比为2:1
C . 气球①和气球④中气体分子数相等
D . 气球③和气球④中气体物质的量之比为1:4
下列叙述中,正确的是( )
A . 标准状况下,22.4L水所含的水分子数目为NA
B . 常温常压下,等物质的量的CH4和CO所含的分子数相等
C . 1LCO气体一定比1L O2的质量小
D . 常温常压下,17g氨气的体积约为22.4L
根据所学知识回答下列问题:
-
(1) 标准状况下,8g
 的体积为L。
的体积为L。
-
(2) 同温同压下,等体积的CO和
 的分子数之比为,密度之比为。
的分子数之比为,密度之比为。
-
(3) 医用生理盐水( 密度近似为
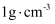 )中NaCl的质量分数为0.9%,则医用生理盐水中
)中NaCl的质量分数为0.9%,则医用生理盐水中 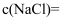 ( 保留2位有效数字)
( 保留2位有效数字)  。
。
-
(4) 标准状况下,
 气体溶于1000g水中,得到的盐酸的密度为
气体溶于1000g水中,得到的盐酸的密度为 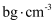 ,则该盐酸的物质的量浓度为
,则该盐酸的物质的量浓度为  。
。
-
(5) 将10mL
 溶液加水稀释至100mL,取出稀释后的溶液20mL,则取出的20mL溶液中
溶液加水稀释至100mL,取出稀释后的溶液20mL,则取出的20mL溶液中 
 。
。
-
(1) 某气态烃A在标况下的密度是1.34g/L,其相对分子质量为:。
-
(2) 根据(1)中信息,该烃A中碳元素的质量分数为80%,则其一氯取代物有几种:。
有600mL某种混合物溶液,只可能含有以下离子中的若干种:K+、  、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、  、
、  ,现将此溶液分成三等份,进行如下实验:
,现将此溶液分成三等份,进行如下实验:
 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、  、
、  ,现将此溶液分成三等份,进行如下实验:
,现将此溶液分成三等份,进行如下实验: ①向第一份中加入AgNO3溶液,有沉淀产生;
②向第二份中加足量NaOH溶液并加热后,收集到气体0.04mol;
③向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测错误的是( )
A . K+一定存在,且n(K+)≥0.02mol
B . Ba2+、Mg2+一定不存
C . Cl-一定存在,且其物质的量比K+小
D . 混合溶液中  的浓度为0.1mol/L
的浓度为0.1mol/L
 的浓度为0.1mol/L
的浓度为0.1mol/L
 代表阿伏加德罗常数的值,下列说法正确的是( )
代表阿伏加德罗常数的值,下列说法正确的是( )
A . 将  溶于水,溶液中阳离子总数为
溶于水,溶液中阳离子总数为  B . 将
B . 将 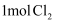 与足量的甲烷在光照条件下充分反应,直至混合气体变为无色,生成
与足量的甲烷在光照条件下充分反应,直至混合气体变为无色,生成  的数目为
的数目为  C . 向
C . 向  的
的  溶液中通入适量氨气至中性,此时溶液中
溶液中通入适量氨气至中性,此时溶液中  的数目为
的数目为  D . 标准状况下,
D . 标准状况下,  由
由  和
和  组成的混合气体中分子总数为
组成的混合气体中分子总数为 
 溶于水,溶液中阳离子总数为
溶于水,溶液中阳离子总数为  B . 将
B . 将 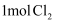 与足量的甲烷在光照条件下充分反应,直至混合气体变为无色,生成
与足量的甲烷在光照条件下充分反应,直至混合气体变为无色,生成  的数目为
的数目为  C . 向
C . 向  的
的  溶液中通入适量氨气至中性,此时溶液中
溶液中通入适量氨气至中性,此时溶液中  的数目为
的数目为  D . 标准状况下,
D . 标准状况下,  由
由  和
和  组成的混合气体中分子总数为
组成的混合气体中分子总数为 
将24.5gKClO3固体与8.7gMnO2固体混合加热片刻,得到标况下VL气体,冷却后固体质量为25.52g;再将剩余固体溶于水并加入足量亚硝酸钠和硝酸银溶液,再加足量的稀硝酸,过滤、洗涤、干燥得到m克固体。求:
-
(1) 标准状况下气体体积V为。
-
(2) 最后所得固体质量m为g。
设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A . 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
B . 将0.1mol氯化铁溶于1L水中,所得溶液含有的Fe3+数目为0.1NA
C . 硝酸与铜反应得到NO2和N2O4的混合物23 g,则铜失去的电子总数为NA
D . 在100g质量分数为64%的乙酸(C2H418O2)水溶液中,含氢原子总数为8NA
已知mmol某体的质量为ag,则bg该气体在标准状况下的体积(L)为( )
A . 22.4am/b
B . 22.4b/am
C . 22.4bm/a
D . 22.4a/bm
将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计(装置如图),若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47g。下列叙述错误的是( )

A . 无论a和b是否连接,稀硫酸均参与反应
B . a和b用导线连接时锌片为负极,发生的反应式为:Zn-2e-=Zn2+
C . 该过程中产生H2(标准状况下)的体积为4.48L
D . 电子从锌电极流出,经导线流入铜电极,经过电解质溶液回到锌电极
最近更新



