元素周期表中原子结构与元素性质的递变规律 知识点题库
下列不能作为元素周期表中元素排列的顺序的依据是( )
A . 原子的核电荷数
B . 原子的中子数
C . 原子的质子数
D . 原子的核外电子数
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.
-
(1) 从以上元素中选择,在自然界中有游离态存在的除铁、硫外还有 元素(填元素符号).
-
(2) 离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后可观察到右边的现象为 , 左边发生反应的离子方程式: 若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2molNH4Al(SO4)2的溶液,右边充满含3molBa(OH)2的溶液,当有2molSO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为

-
(3) 某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
①若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为 .
②若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 ;然后向滤液中继续加适量乙酸乙酯并加热可得沉淀,写出生成沉淀的离子方程式
根据反应:2Na2CO3+SnO2+4S Na2SO4+Na2SnS3+2CO2↑回答下列问题:
Na2SO4+Na2SnS3+2CO2↑回答下列问题:
 Na2SO4+Na2SnS3+2CO2↑回答下列问题:
Na2SO4+Na2SnS3+2CO2↑回答下列问题:
-
(1) 上述反应涉及的元素中,非金属性最强的元素最外层电子排布式为 ,在上述反应的生成物中,属于分子晶体的化合物的结构式为
-
(2) 在上述反应中单质物质的原子核外共有 种不同运动状态的电子,有 种不同能量的电子.
-
(3) 上述反应中,金属性最强的元素与铝元素相比较,可以作为判断两者金属性强弱依据的是 (选填编号).
a.能否置换出硫酸铜溶液中的铜离子
b.Al(OH)3能否溶解在该元素最高价氧化物对应的水化物中
c.单质与氯气化合时失去电子数目的多少
d.单质与同浓度的稀盐酸发生反应的剧烈程度
-
(4) 上述反应中氧化剂与还原剂的物质的量之比是
-
(5) 常温下,测得Na2SnS3溶液pH>7,请用离子方程式解释其原因:
-
(6) 锡(Sn)元素的单质有两种常见的同素异形体﹣﹣灰锡和白锡.
已知:Sn(s、灰)
 Sn(s、白)﹣2.1kJ,根据以上信息得出的结论正确的是 .
Sn(s、白)﹣2.1kJ,根据以上信息得出的结论正确的是 .a.灰锡和白锡的互相转化是可逆反应
b.常温下锡主要以灰锡的状态存在
c.白锡所具有的能量高
d.同素异形体的相互转化肯定也是化学变化,但却不属于氧化还原反应.
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2 , 其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
A . 原子半径:Y>Z>R>T
B . 气态氢化物的稳定性:W<R<T
C . 最高价氧化物对应的水化物的碱性:X>Z
D . XR2、WR2两种化合物中R的化合价相同
已知aAn+、bB(n+1)+、cCn﹣、dD(n+1)﹣均具有相同的电子层结构,关于A,B,C,D四种元素的叙述正确的是( )
A . 原子半径:A>B>C>D
B . 原子序数:b>a>c>d
C . 离子半径:D>C>B>A
D . 金属性:B>A,非金属性:D>C
X,Y,Z,W,R属于短周期主族元素.X的原子半径短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m﹣n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述错误的是( )
A . X与Y形成的两种化合物中阴、阳离子的个数比均为1:2
B . Y的氢化物比R的氢化物稳定,熔沸点高
C . Z,W,R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D . RY2、WY2通入BaCl2溶液中均有白色沉淀生成
下列叙述能肯定金属A比金属B更活泼的是( )
A . A原子的最外层电子数比B原子的最外层电子数少
B . A原子的电子层数比B原子多
C . 1 mol A从酸中置换出H2比1 mol B多
D . 常温下,A能从酸中置换出氢气,而B不能
短周期元素A,B,C,D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A,C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
A . D元素处于元素周期表中第3周期VIA族
B . 四种元素的原子半径:A<B<C<D
C . B,D的最高价氧化物具有相似的物理性质和化学性质
D . 一定条件下,B单质能置换出D单质,C单质能置换出A单质
已知aAn+、bB(n+1)+、cCn﹣、dD(n+1)﹣具有相同的电子层结构,关于A、B、C、D四种元素叙述正确的是( )
A . 气态氢化物的稳定性:D>C
B . 原子半径:B>A>C>D
C . 单质的还原性:B>A
D . 原子序数:b>a>c>d
“类推”常用的学习方法,但有时会产生错误结论.下列类推的结论中,正确的是( )
A . Ⅳ A族元素氢化物沸点顺序是GeH4>SiH4>CH4 , 则VA族元素氢化物沸点顺序也是AsH3>PH3>NH3
B . 常见的氢化物是分子晶体,则所有氧化物都是分子晶体
C . 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
D . 第二周期元素氢化物稳定性顺序是HF>H2O>NH3 , 则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是( )
A . 比较这两种元素的单质的硬度和熔点
B . 向氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
C . 使在空气中久置的镁带和铝片分别与热水作用,并滴入酚酞溶液
D . 将铝片和镁片分别投入氢氧化钠溶液中,Al能与NaOH溶液反应放出氢气,而Mg不能
下列有关性质的比较,不能用元素周期律解释的是( )
A . 碱性:KOH>NaOH
B . 金属性:Na>Mg
C . 稳定性:HF>CH4
D . 酸性:HF<HCl
下列性质的递变规律错误的是( )
A . NaOH、KOH、CsOH碱性依次增强
B . Li、Na、K、Rb、Cs的失电子能力逐渐增强
C . Al3+、Mg2+、Na+的离子半径依次减小
D . F2、Cl2、Br2、I2的熔沸点依次升高、密度依次增大
铅(Pb)的原子序数为82,有+2、+4两种常见化合价。PbO2随温度的升高发生如下变化:PbO2→Pb2O3→Pb3O4→PbO。下列说法错误的是()
A . Pb位于周期表ⅣA族
B . Pb3O4可以写成2PbO·PbO2
C . PbO2分解生成Pb2O3同时生成O2
D . PbO2可作为铅蓄电池的正极,放电时发生氧化反应
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm)
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/mm |
0.16 |
0.143 |
0.102 |
0.099 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
-1 |
-2 |
-
(1) 用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)

-
(2) B元素处于周期表中第周期第族。
-
(3) B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式。
-
(4) 上述五种元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式)。
-
(5) C,E形成的化合物为(填化学式)
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
下列叙述错误的是( )
A . R的氧化物对应的水化物可能具有两性
B . X单质在氧气中燃烧不可能生成XO3
C . 离子半径大小:r(M3+)<r(T2-)
D . L2+和X2-的电子层结构相同
据国外有关资料报道,在“独居石”(一种共生矿,化学成分为Ce、La、Nb等的磷酸盐)中,查明有尚未命名的116,124,126号元素。已知116号元素与氧元素同主族,下列关于116号元素判断正确的是( )
A . 元素周期表中的位置是:第7周期,第ⅥA族
B . 是非金属元素
C . 单质有很强的氧化性
D . 常温常压下为气态
已知X、Y、Z、W为原子序数依次增大的短周期元素,X、W不在同一周期,且W的最外层电子数是Y最外层电子数的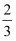 , 其形成的一种化合物结构如图所示,下列叙述错误的是( )
, 其形成的一种化合物结构如图所示,下列叙述错误的是( )
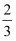 , 其形成的一种化合物结构如图所示,下列叙述错误的是( )
, 其形成的一种化合物结构如图所示,下列叙述错误的是( )
A . 原子半径W>X>Y>Z
B . X的氧化物水化物可能是弱酸
C . 简单氢化物水溶液的pH: X>Y>Z
D . WY2性质活泼,溶于水可得到对应酸溶液
2021年6月17日,我国神舟十二号载人飞船成功发射,中国空间站和国际空间站将同时在轨运营,此举开创了国际航天事业的新篇章,制造神舟十二号载人飞船的材料中含有的主族元素W、X、Y、Z,分布在三个短周期中,其原子序数依次增大,X、Z同主族,X的最外层电子数是W和Y的最外层电子数之和,它们的单质中只有Y的单质为金属,能与NaOH溶液反应。下列叙述正确的是( )
A . 原子半径大小顺序为Z>Y>X>W
B . Z的氧化物为酸性氧化物,能与水反应生成对应的酸
C . W与X形成的化合物分子都呈正四面体结构
D . Z单质可广泛应用于制造光电池、芯片等
科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )

A . 原子半径: 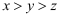 B . 非金属性:
B . 非金属性:  C . Z的单质具有较强的还原性
D . 原子序数为82的元素与W位于同一主族
C . Z的单质具有较强的还原性
D . 原子序数为82的元素与W位于同一主族
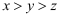 B . 非金属性:
B . 非金属性:  C . Z的单质具有较强的还原性
D . 原子序数为82的元素与W位于同一主族
C . Z的单质具有较强的还原性
D . 原子序数为82的元素与W位于同一主族
最近更新



