河北九年级化学期末考试(2019年上册)免费检测试卷
| 1. 选择题 | 详细信息 |
|
下列物质中,属于纯净物的是( ) A. 空气 B. 不锈钢 C. 蒸馏水 D. 澄清石灰水 |
|
| 2. 选择题 | 详细信息 |
|
将下列物质分别加入足量水中,能形成溶液的是( ) A. 泥沙 B. 蔗糖 C. 汽油 D. 花生油 |
|
| 3. 选择题 | 详细信息 |
|
在盛有水的烧杯中分别加入下列物质,在形成溶液的过程中温度明显降低的是 A. 硝酸铵 B. 氯化钠 C. 浓硫酸 D. 氢氧化钠 |
|
| 4. 选择题 | 详细信息 |
|
下列关于CO和CO2说法正确的是 A.都能溶于水 B.都能燃烧、放热 C.都是无毒气体 D.都可由碳与氧气反应制得 |
|
| 5. 选择题 | 详细信息 |
|
下列物质中,含糖类比较丰富的是( ) A. 鸡蛋 B. 黄瓜 C. 大米 D. 花生油 |
|
| 6. 选择题 | 详细信息 |
|
下列所给的材料中,不属于合成有机高分子材料的是( ) A. 塑料 B. 钢铁 C. 合成橡胶 D. 合成纤维 |
|
| 7. 选择题 | 详细信息 |
|
下列有关燃烧和灭火的说法正确的是( ) A. 油锅着火,泼水灭火 B. 通过降低可燃物的着火点可以灭火 C. 任何燃料完全燃烧时,一定会生成二氧化碳 D. 空气中混有可燃性气体,遇明火时可能发生爆炸 |
|
| 8. 选择题 | 详细信息 |
|
下列清洗方法中,利用乳化原理的是 A.用自来水洗手 B.用汽油溶解油污 C.用洗涤剂清洗餐具 D.用盐酸清除试剂瓶壁上的碳酸钙 |
|
| 9. 选择题 | 详细信息 |
|
有A、B、C三种+2价金属,它们之间有如下关系: (1)A + B(NO3)2 = A(NO3)2 + B (2)C+H2SO4=CSO4+H2↑ (3)A+H2SO4不反应 则它们的金属活动性由强到弱的排列是( ) A.A>B>C B.B>A>C C.C>A>B D.A>C>B |
|
| 10. 选择题 | 详细信息 |
|
“生命至上、安全第一”,为及时发现天然气泄漏,某燃气公司常在天然气中加入少量具有特殊气味的乙硫醇(C2H5SH)。乙硫醇在空气中也能燃烧,反应的化学方程式为: 2C2H5SH+9O2 A. 乙硫醇是由三种元素组成的有机物 B. X 的化学式为 SO2 C. 乙硫醇中碳、氢、硫元素的质量比为 12∶3∶16 D. 乙硫醇中碳元素的质量分数最大 |
|
| 11. 选择题 | 详细信息 |
|
推理是一种重要的学习方法。下列推理得出的相关结论正确的是( ) A. 含碳元素的物质充分燃烧会生成 B. 铁丝在氧气中能够燃烧,空气中有氧气,所以铁丝在空气中一定能够燃烧 C. 二氧化碳能使燃着木条熄灭,所以能使燃着木条熄灭的气体一定是二氧化碳 D. 水与过氧化氢都是由氢、氧元素组成的化合物,所以它们的性质完全相同 |
|
| 12. 选择题 | 详细信息 |
|
将 4g 一氧化碳和二氧化碳的混合气体,通入足量的澄清石灰水中结果得白色沉淀 5g,则原混合气体中一 氧化碳的质量分数为( ) A. |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
下列实验操作不能达到实验目的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
下列有关溶液的说法中,正确的是( ) A. 饱和溶液一定比不饱和溶液所含的溶质多 B. 升高温度或增大压强均可以增大气体在水中的溶解度 C. 将 100g 溶质质量分数为 D. 将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小 |
|
| 15. 选择题 | 详细信息 |
|
下列说法错误的是( ) A. 质量相等的 B. C. 某化合物 D. 取一定量铁与铜的混合物,向其中加入 50g 溶质质量分数为 |
|
| 16. 填空题 | 详细信息 |
|
现有:①钙 ②氮气 ③石墨 ④维生素A ⑤一氧化碳 ⑥二氧化碳,请根据题意回答问题(填序号) (1)空气中含量最多的气体是:______; (2)可作干电池电极的是:______; (3)能使紫色石蕊试液变红的气体是:______; (4)人体中含量最高的金属元素是:______; (5)能使氧化铜变成铜的氧化物的是:______; (6)患有夜盲症的病人是由于体内缺乏:______。 |
|
| 17. 填空题 | 详细信息 |
|
化学与生活密切相关,请回答: (1)金刚石、C60 都是碳元素组成的单质,关于它们的说法不正确的是______(填序号)。 A.碳原子的排列不同B.是同一种物质C.完全燃烧都生成二氧化碳 (2)能源与环境已经成为人们日益关注的问题。目前人们利用最多的能源是煤、______和天然气。煤燃烧会产生大量的二氧化碳、二氧化硫和一氧化碳等气体,其中会引起“温室效应”的气体是______(填化学式),会导致酸雨的气体是______(填化学式)。 (3)石油炼制的产品之一是汽油。在汽油中加入适量乙醇作为汽车燃料。可适当节省石油资源。请写出乙醇在空气中完全燃烧的化学方程式______。 |
|
| 18. 填空题 | 详细信息 |
|
完成下列化学方程式 (1)常温下铝与氧气反应______; (2)一氧化碳与氧化铁反应______; (3)镁与盐酸反应______。 |
|
| 19. 简答题 | 详细信息 |
|
铁在日常生活中有着重要作用。请回答: (1)铁生锈实际上是铁与空气中的氧气和______(填名称)发生反应的结果,生活中可以采用______(写一种方法即可)的方法防止铁制品生锈。 (2)铁在高温下与水蒸气反应生成四氧化三铁和氢气。该反应的化学方程式为:______,该反应属于______反应(填基本反应类型)。 |
|
| 20. 填空题 | 详细信息 |
|
实验室准备配制 50g 溶质质量分数为 10%的氯化钠溶液,问: (1)需要固体氯化钠多少克_______? (2)如改用 20%的氯化钠溶液进行配置,则需要 20%的氯化钠溶液多少克______? |
|
| 21. 计算题 | 详细信息 |
|
今有铜、锌混合物 20g,该混合物恰好与 200g 稀盐酸中完全反应,生成 0.4g 氢气。试回答: (1)铜、锌混合物中金属锌的质量为多少_______? (2)该稀盐酸中溶质的质量分数为多少_______?(精确到 0.1%) (3)反应后溶液中溶质的质量分数为多少_______?(精确到 0.1%) |
|
| 22. 推断题 | 详细信息 |
甲、乙、丙是仅由碳、氧两种元素组成的单质或化合物,其中丁由钙、氧和碳三种元素组成。它们之间的转化关系如图所示(图中部分反应物、生成物及反应条件已略去)。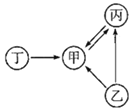 (1)写出下列物质的化学式:甲______、丙______。 (2)实验室制取甲的化学方程式______。 (3)写出甲与澄清石灰水发生反应的化学方程式______。 (4)由甲转化为丙的化学方程式______。 |
|
| 23. 推断题 | 详细信息 |
A-G 都是初中化学常见的物质。已知 A 和 G 均为黑色固体,C 为红色固体单质,B、E、F 为无色气体,D为无色液体。它们的转化关系如图所示(部分条件略去)。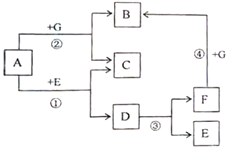 (1)写出 A、B、E 的化学式 A:______,B:______,E:______。 (2)反应①的化学方程式为:______。 (3)反应②的化学方程式为:______。 |
|
| 24. 简答题 | 详细信息 |
|
金属材料与人类的生产和生活密切相关。请回答: (1)下列用品中,主要利用金属导电性的是:______(填字母)。 A.铂金饰品; B.铁锅; C.铝导线; (2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列三种方案,其中可行的是:______(填序号)。 ①将铝、银分别浸入到硫酸铜溶液中 ②将银分别浸入到硫酸铝、硫酸铜溶液中 ③将铜、银分别浸入到硫酸铝溶液中 (3)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液。 ①滤液中一定含有的溶质是:______(填化学式);可能含有的溶质是:______(填化学式) ②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是:______(填化学式)。 (4)某钢铁厂每天需消耗 4900t 含 Fe2O3 76%的赤铁矿石,该厂理论上可日产含 Fe 98%的生铁的质量是:______t。 |
|
| 25. 简答题 | 详细信息 |
如图是甲、乙、丙三种固体物质的溶解度曲线,回答问题: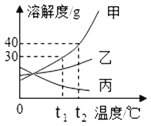 (1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是:______; (2)t2℃时,将 45g 甲加入到 50g 水中,充分溶解,所得溶液的质量为______g; (3)要使 t1℃时,接近饱和的乙溶液变成该温度下的饱和溶液,可采取的方法是______(写一种即可)。 (4)将 t2℃时丙物质的饱和溶液降温到 t1℃,此时该溶液的溶质质量分数______(填“变大”、“变小”或者“不变”)。 |
|
| 26. 实验探究题 | 详细信息 |
如图为实验室常用的一些实验装置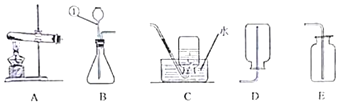 回答下列问题: (1)写出带标号仪器①的名称:______; (2)写出锌和稀硫酸反应的化学方程式:______; (3)实验室收集 CO2 气体的装置是:______; (4)通常状况下,NH3 为无色、密度小于空气且极易溶于水的气体。实验室制取 NH3 的原理为:将氢氧化钙 与氯化铵两种固体混合物进行加热生成物为:氯化钙、氨气和水,根据以上的信息,写出实验室制取氨气的化学 方程式:______。 |
|
| 27. 实验探究题 | 详细信息 |
配置溶质质量分数为 12%的氯化钠溶液 60g,有以下操作。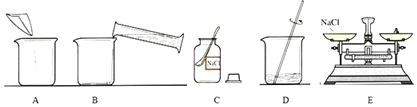 (1)配置该溶液的正确操作顺序为:______(填字母序号)。 (2)在配置该溶液的过程中玻璃棒的作用:______。 (3)已知 20℃时氯化钠的溶解度为 36.0g,现在有 20℃的溶质质量分数为 24%的氯化钠溶液,此时该溶液为______溶液(填“饱和”或“不饱和”)。 |
|
初中化学 试卷推荐
- 2019届九年级上学期期末联考化学试卷完整版(甘肃省静宁县第二大片区)
- 安徽省宿州市埇桥区教育集团2020-2021年初三上册第三次月考化学在线测验完整版
- 山东省济宁市鱼台县实验中学2020-2021年九年级上半期期中化学在线测验完整版
- 2019届初三下半年中考模拟化学试卷完整版(湖北省十堰市官渡镇中学)
- 2019-2020年初三上半年期末化学题开卷有益(湖北省鄂州市梁子湖区)
- 2019-2020年九年级前半期期中化学在线测验完整版(山东省菏泽市成武县)
- 初三下学期期中化学题免费试卷(2019-2020年黑龙江省齐齐哈尔市建华区朝鲜族学校)
- 2020年5月黑龙江省哈尔滨市南岗区萧红中学中考模拟化学考题
最近更新



