荆州市2019年九年级化学下学期中考模拟在线答题
| 1. | 详细信息 |
|
下列变化属于化学变化的是( ) A. 石蜡熔化 B. 潮湿的衣服被晒干了 C. 钢铁生锈 D. 水变成水蒸气 |
|
| 2. | 详细信息 |
|
以下物质属于纯净物的是( ) A. 白酒 B. 牛奶 C. 冰水混合物 D. 可口可乐 |
|
| 3. | 详细信息 |
|
下列金属不能与CuSO4溶液反应的是( ) A. Ag B. Fe C. Zn D. Al |
|
| 4. | 详细信息 |
|
下列实验操作正确的是( ) A. 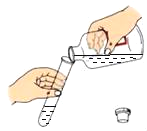 B. B.  C. 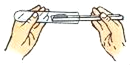 D. D. 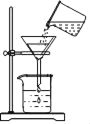 |
|
| 5. | 详细信息 |
|
“无土栽培”是一项利用化学试剂配制成的营养液来栽培植物的新技术。下列是某营养液所含的主要成分 ,其中属于复合肥料的是 A. 铵磷钾 B. 硫酸钾 C. 钙镁磷肥 D. 硫酸铵 |
|
| 6. | 详细信息 |
|
关于化学方程式2HgO A. 2份质量的氧化汞加热分解生成2份质量的汞和1份质量的氧气 B. 2个氧化汞分子加热分解生成2个汞分子和一个氧分子 C. 此化学反应生成了两种新微粒:汞原子和氧分子 D. 此化学反应中原子的种类和个数没有改变 |
|
| 7. | 详细信息 |
|
下列说法不正确的是 ( ) A. 在钢铁表面镀铬能防止钢铁生锈 B. 盐酸具有酸性,可用于洗涤油污 C. 熟石灰具有碱性,可用来改良酸性土壤 D. 氮气化学性质不活泼,可用来作焊接金属的保护气 |
|
| 8. | 详细信息 |
|
推理是一种重要的化学思维方法,以下推理合理的是( ) A.因为MnO2能加快H2O2的分解速率,所以MnO2也能加快H2O的分解 B.因为单质是由同种元素组成,所以只含一种元素的物质一定是单质 C.因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有碳元素和氢元素 D.中和反应一定有盐和水生成,所以有盐和水生成的反应一定是中和反应 |
|
| 9. | 详细信息 |
|
下列物质能在pH=1的无色溶液中大量共存的是( ) A. NaNO3、NaCl、KNO3、(NH4)2SO4 B. H2SO4、HCl、AgNO3、Na2SO4 C. KMnO4、CuCl2、Fe2(SO4)3、NaNO3 D. K2SO4、NaCl、K2CO3、NaOH |
|
| 10. | 详细信息 |
|
在M2O3中,氧元素的质量分数是30%,则M的相对原子质量是( ) A. 16 B. 32 C. 56 D. 64 |
|
| 11. | 详细信息 |
|
化学与生活生产密切相关,我们的生活离不开化学.请回答下列问题: (1)暖壶用久了以后会出现一层水垢,我们可以用厨房中常见的_____来除去. (2)我们可以在冰箱中放入一些_____(选填“活性炭”或“碳酸饮料”)来吸收冰箱中的异味. (3)小琳的野炊食谱为:牛肉、面包、水、加碘食盐、鸡蛋,则其中缺少的营养素是_____. |
|
| 12. | 详细信息 |
|
(1)用化学用语填空 ①2个氧原子:_____; ②钙离子:_____; ③+2价的镁元素:_____; ④1个氮分子:_____; ⑤五氧化二氮_____. (2)写出下列化学反应的符号表达式: 铁丝在氧气中燃烧_____ 过氧化氢和二氧化锰制取氧气_____. |
|
| 13. | 详细信息 |
|
某粒子的结构示意图为 ①当a=_______时,该粒子是原子,该原子位于元素周期表中第_______周期。 ②当a=8时,该粒子是__________(填“原子”、“阳离子”或 “阴离子”)。 |
|
| 14. | 详细信息 |
如图1是甲、乙、丙三种物质的溶解度曲线.请看图回答.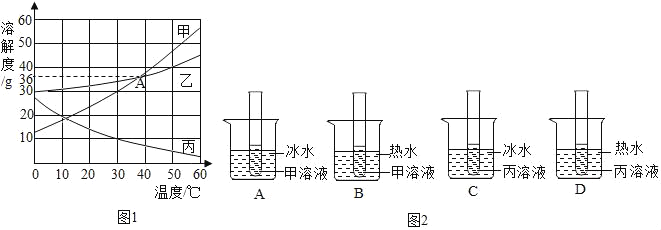 ①20℃时,甲乙丙三种物质的溶解度由大到小的顺序_____ ②图中A点表示的意义是_____. ③在室温时,将分别盛有甲、丙饱和溶液的试管各两支,分别放入盛有冰水或热水的烧杯中.根据甲、丙两物质的溶解度曲线,判断图2试管内所示现象正确的是_____(填字母序号),该现象被叫做_____. |
|
| 15. | 详细信息 |
已知A、B为两种黑色粉末,D为红色金属.C、F都是无色气体,A、B、C、D、E、F五种物质之间的转化关系如图所示.(部分生成物已省略)请回答: (1)B的化学式为_____;D的化学式为_____. (2)反应①的基本反应类型是_____;反应②的化学方程式为_____;在上述反应中A、F都具有_____性. (3)将两只用于医学研究的小白鼠分别放入盛放C、F的两个瓶中,拧紧瓶盖,结果两只小白鼠很快都死了.造成小白鼠死亡的主要原因_____(填“相同”或“不同”). |
|
| 16. | 详细信息 |
根据下列实验装置图,回答问题: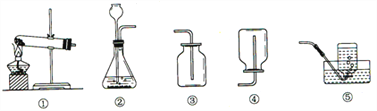 (1)实验室用高锰酸钾制氧气应选用的发生装置是_________(填序号,下同)。 (2)实验室制取二氧化碳选用的收集装置是__________________,验证二氧化碳收集满的方法是______________________________________________(写出操作、现象、结论) (3)实验室收集某气体只能用装置④,由此说明该气体具有的物理性质是______________ |
|
| 17. | 详细信息 | |||||||||||
已知氧化铜还原成铜的过程中有氧化亚铜生成。如图是小华同学用CO还原氧化铜的实验装置图,当玻璃管中黑色物质全部变红后,小华想知道红色物质中有哪些成分?请你与小华一起完成下面的探究。 【提出猜想】①全部是铜; ②全部是氧化亚铜;③是铜和氧化亚铜的混合物。 【查阅资料】氧化亚铜是一种红色固体,能与稀硫酸发生如下反应: Cu2O+H2SO4=Cu+CuSO4+H2O 【设计实验】为了验证这些猜想,小华同学进行了以下探究活动,请完成下列问题:
|
||||||||||||
| 18. | 详细信息 |
某粗盐中除NaCl以外还含有少量杂质MgCl2,为了测定粗盐中MgCl2的质量分数。取固体样品50.0g完全溶解于150.0g水中,并向其中逐渐加入一定浓度的NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如图所示: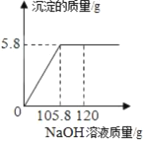 注:发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl 请根据相关信息完成下列计算: (1)反应完全时,生成氢氧化镁的质量为_____g; (2)在粗盐中氯化镁的质量分数;_____ (3)恰好完全反应时得到的溶液中溶质的质量分数。_____ |
|
最近更新



