绍兴市高一化学上册期末考试刷题训练
| 1. 选择题 | 详细信息 |
|
将空气中氮气转化成氮的化合物的过程称为固氮。下图中能实现人工固氮的是( ) A. 闪电  B. 电解食盐水车间 B. 电解食盐水车间 C. 根瘤菌  D. 合成氨车间 D. 合成氨车间 |
|
| 2. 选择题 | 详细信息 |
|
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( ) ①幕布的着火点升高 ②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气 A.①② B.③④ C.①③ D.②④ |
|
| 3. 选择题 | 详细信息 |
|
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是 A.1:4 B.4:1 C.2:3 D.2:5 |
|
| 4. 选择题 | 详细信息 |
|
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为 A.NO2 B.N2O5 C.N2O D.N2O4 |
|
| 5. 选择题 | 详细信息 |
|
已知25%氨水的密度为0.91 g·cm-3,5%氨水的密度为0.98 g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是 A.等于15% B.大于15% C.小于15% D.无法估算 |
|
| 6. 选择题 | 详细信息 |
|
将NH4HCO3置于干的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和碱石灰的干燥管,最后得到的气体有( ) A.NH3、O2 B.H2O、O2 C.CO2、O2 D.O2 |
|
| 7. 选择题 | 详细信息 |
|
下列物质的水溶液中,除了水分子外,不存在其他分子的是 A.NaHSO3 B.NH4NO3 C.HNO3 D.CH3COONa |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是 A.分子内共价键越强,分子越稳定,其形成的晶体的熔沸点也越高 B.离子键的本质就是阴、阳离子之间的相互吸引 C.金刚石转化为石墨的过程中不存在化学键被破坏的过程 D.由原子构成的晶体可能是原子晶体,也可能是分子晶体 |
|
| 9. 选择题 | 详细信息 | ||||||||||||
下表为元素周期表的一部分。X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍。下列说法不正确的是
|
|||||||||||||
| 10. 选择题 | 详细信息 |
|
pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是 A.加入适量的氯化铵晶体后,两溶液的pH均碱小 B.温度下降10°C,两溶液的pH均不变 C.分别加水稀释10倍,两溶液的pH仍相等 D.用同浓度的盐酸中和,消耗盐酸的体积相同 |
|
| 11. 选择题 | 详细信息 |
|
下列可用于测定溶液pH且精确度最高的是 A. 酸碱指示剂 B. pH计 C. 精密pH试纸 D. 广泛pH试纸 |
|
| 12. 选择题 | 详细信息 |
支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是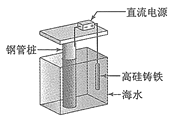 A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极 B.高硅铸铁的作用是作为损耗阳极材料和传递电流 C.通入的保护电流应该根据环境条件变化进行调整 D.通入的保护电流应使钢管桩表面腐蚀电流接近于零 |
|
| 13. 选择题 | 详细信息 |
图中的原电池可以测定AgCl的沉淀溶解平衡常数。有关该原电池的说法不正确的是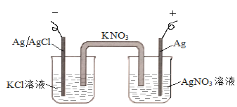 A.负极的电极反应式为:Ag+Cl--e-=AgCl B.正极的电极反应式是Ag++ e-=Ag C.电池总反应不是氧化还原反应,不能组成原电池 D.反应时,盐桥中的K+移向AgNO3溶液,NO3-移向KCl溶液 |
|
| 14. 选择题 | 详细信息 |
|
常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是 A.c(OH-)<1.0×10-7mol/L B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) C.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-) D.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-) |
|
| 15. 选择题 | 详细信息 |
|
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 B.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 C.平衡时,其他条件不变,增加NH3的浓度,逆反应速率将减小 D.其他条件不变,使用高效催化剂,废气中氮氧化物的平衡转化率增大 |
|
| 16. 选择题 | 详细信息 |
|
H2和I2在一定条件下能发生反应:H2(g)+I2(g) 下列说法正确的是 A.H2、I2和HI分子中的化学键都是非极性共价键 B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量 D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ |
|
| 17. 选择题 | 详细信息 |
|
下列说法正确的是 A.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水) B.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 C.Na2CO3溶液呈碱性的原因:CO32-+2H2O⇌H2CO3+2OH- D.0.1 mol∙Lˉ1CH3COOH溶液加水稀释,CH3COO- 数目增多,c(OH-)减少 |
|
| 18. 选择题 | 详细信息 | ||||||||||||||||||||||||||
某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)⇌2NO2(g),在其他条件相同时,测得实验数据如表:
|
|||||||||||||||||||||||||||
| 19. 选择题 | 详细信息 |
常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是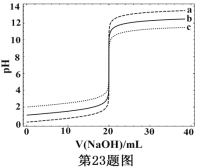 A. 3种HCl溶液的c(HCl):最大的是最小的100倍 B. 曲线a、b、c对应的c(NaOH):a>b>c C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-) D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大 |
|
| 20. 综合题 | 详细信息 |
|
2019年是门捷列夫提出元素周期表150周年。已知在元素周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。W与Q可以形成一种高温结构陶瓷材料,W的氯化物分子呈正四面体结构。回答下列问题: (1)元素X在元素周期表中的位置_________ (2)W的氧化物的晶体类型是____________ (3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是________ (4)这5个元素的氢化物分子中: ①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)_______ ②电子总数相同的氢化物的化学式和立体结构分别是_________ (5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是_________。 |
|
| 21. 实验题 | 详细信息 |
|
某化学学习小组设计实验制取氨气并探究氨气的有关性质: (1)实验室制备氨气,下列方法中适宜选用的是 ___________(填编号) A . 氯化铵溶液与氢氧化钠溶液共热 B. 固体氢氧化钠中滴加浓氨水 C. 固态氯化铵加热分解 D. 固态硝酸铵加热分解 E. 固态氯化铵与熟石灰混合加热 (2)该小组成员设计实验制备氨气并探究氨气的还原性及产物,提供实验装置如图: 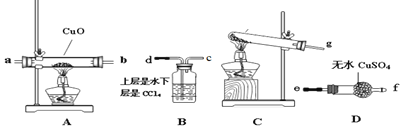 ①装置C中发生反应的化学方程式为______________ ②根据上述提供的装置正确的连接顺序为____________(用各接口序号表示) ③该装置在设计上有一定的缺陷,你对该装置的改进措施是___________。 (3)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式________ (4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________。已知:Cu2O+2H+=Cu+Cu2+ +H2O |
|
| 22. | 详细信息 |
硝酸铵常用作化肥和化工原料,工业上制备硝酸铵的简要流程如图: (1)中和器中主要反应的化学方程式为___________ (2)制备硝酸铵采用加压中和法还是常压中和法?同时说明原因___________ (3)在不同的反应条件下,中和器中硝酸浓度与硝酸铵含量存在如图关系: 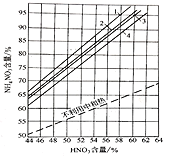 [不利用中和热及在不同情况下利用中和热时生产硝铵溶液中NH4NO3的含量1-HNO3和NH3(70℃);2-HNO3和NH3(50℃);3-HNO3(50℃)和NH3(20℃);4-HNO3和NH3(20℃)] ①按图中的数据分析,要使中和器中硝酸铵含量达到90%以上,原料最佳温度和硝酸最佳含量是__________ A. 70℃;58% B. HNO3(50℃),NH3(20℃);56% C. 50℃;56% D. 20℃;58% ②中和器中产品检测时,工作人员发现N2浓度明显高于正常空气带入的N2浓度,试用化学方程式表示中和器中生成N2的最有可能的过程____________ 、___________ ③以下制备硝酸铵分析不正确的是___________ A. 硝酸铵制备中应利用反应的中和热用于预热原料和浓缩硝酸铵溶液。 B. 采用真空蒸发器有利于获得较高浓度的硝酸铵溶液和较大颗粒的硝酸铵晶体析出。 C. 已知NH3与HNO3的气相反应很不彻底,工艺中应尽量使反应在液相中进行,可将硝酸持续匀速地通入预先装有液氨的中和器中反应。 D.充分回收、重复利用蒸发器的蒸气和冷凝液中的产品,可以降低原料损耗。 |
|
| 23. 填空题 | 详细信息 |
|
25℃时0.1mol•L-1的H2S水溶液中,用氢氧化钠来调节溶液pH,得到含有H2S、HS-、S2-三种微粒的溶液。 (1)当溶液的pH=7时,c(Na+)= __________(填微粒间量的关系)。 (2)当c(Na+)=c(S2-)+c(HS-)+c(H2S)时溶液为____溶液(填物质的化学式)。 |
|
| 24. 实验题 | 详细信息 |
|
草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验: 实验1:准确称取Wg草酸晶体配成100ml水溶液; 实验2:用浓度为0.100mol•L-1KMnO4溶液滴定所配制的草酸溶液,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+ 10CO2↑+2MnSO4+8H2O。 试回答下列问题: (1)实验1中,配制100ml草酸水溶液所需要的一组仪器是________(填相应编号) A、0.001g的电子天平 B、50ml酸式滴定管 C、100ml量筒 D、100ml容量瓶 E、烧杯 F、胶头滴管 G、锥形瓶 (2)实验2中H2C2O4·xH2O中x值的测定是利用氧化还原反应滴定法 ①其中正确操作步骤的顺序为___________ a.用移液管取用25.00ml所配的草酸溶液置于锥形瓶中,加适量的稀硫酸。 b.把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体 c.取KMnO4标准液注入滴定管中至“0”刻度以上 d.调节液面至“0”或“0”刻度以下,记下读数 e.把标准KMnO4溶液润洗滴定管2~3次 f.把锥形瓶放在滴定管下面,用KMnO4标准液滴定至终点并记下滴定管的读数 ②下列关于滴定分析,正确的是________________。 A. 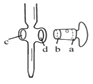 图中,应将凡士林涂在旋塞的a端和旋塞套内的c端 图中,应将凡士林涂在旋塞的a端和旋塞套内的c端B. 滴定前,锥形瓶和滴定管均须用标准溶液润洗 C. 将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 D. 滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转 E. 滴定到终点时俯视读取数据,测得的x值偏大 ③图中滴定终点时显示的读数为_______ mL。 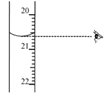 |
|
| 25. 综合题 | 详细信息 |
|
用氨气制取尿素的反应为:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) ΔH<0 (1)该反应能自自发进行的条件是___________ (2)反应在恒容密闭容器中达到平衡时,下列说法不正确的是________ A.加入催化剂,平衡常数不变 B.容器内的压强不再变化 C.容器内的气体密度不再变化 D.降低温度,平衡向正反应方向移动 (3)某温度下,向容积为10L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。 ①该段时间内用NH3表示的平均反应速率为___________ ②该温度下此反应平衡常数K的值为________。 ③图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若在25s时保持其它条件不变情况下使用催化剂,使反应延续至70s,请在图中用实线画出25~70s内该反应的进程曲线__________。 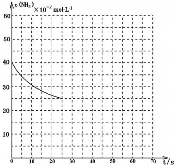 (4)尿素在水溶液中会分解,某研究小组分别用三份不同初始浓度的尿素溶液测定分解反应速率,得到c(CO(NH2)2)随时间变化趋势如图所示: 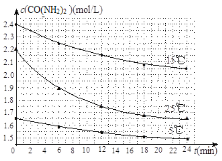 根据图中信息,如何说明分解反应速率随温度升高而增大__________。 |
|
最近更新



