高一下期期末考试化学题免费试卷在线检测(2018-2019年四川省凉山州)
| 1. 选择题 | 详细信息 |
|
下列关于有机物的描述中正确的是 A. 葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体 B. 利用蛋白质的颜色反应可以鉴别所有的蛋白质 C. 多糖、蛋白质、脂肪和聚丙烯等都属于高分子化合物 D. 食醋中的主要成分为乙酸,所以可以用来除水垢 |
|
| 2. 选择题 | 详细信息 |
|
绿色化学“原子经济”指原子利用率达100%,下列反应符合要求的是 A. 乙烯聚合为聚乙烯高分子材料 B. 由苯制硝基苯 C. 以铜和浓硝酸为原料生产硝酸铜 D. 用CO还原氧化铁炼钢 |
|
| 3. 选择题 | 详细信息 |
|
下列化合物中,既含有离子键又含有非极性键的是 A. H2SO4 B. Ca(OH)2 C. Na2O2 D. BaCl2 |
|
| 4. 选择题 | 详细信息 |
|
下列表示物质结构的化学用语正确的是 A. HF的电子式: C. 醋酸的分子式:CH3COOH D. 乙烯的球棍模型: |
|
| 5. 选择题 | 详细信息 |
已知反应 A.该反应为放热反应 B.该反应吸收的能量为 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行 |
|
| 6. 选择题 | 详细信息 |
下列图像分别表示有关反应的反应过程与能量变化的关系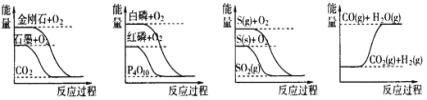 据此判断下列说法中正确的是( ) A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定 C. ①S(g)+O2(g)=SO2(g);②S(s)+O2(g)=SO2(g);放出热量:①˂② D. CO(g)+H2O(g)=CO2(g)+ H2 (g);该反应为吸热反应 |
|
| 7. 选择题 | 详细信息 |
|
下列除去杂质的操作中,能达到目的的是 A. 除去CO2中的少量HCl气体:通过盛有饱和Na2CO3溶液的洗气瓶 B. 除去苯中的少量溴:加入CCl4萃取后分液 C. 除去乙醇中的少量水:加入CaO后蒸馏 D. 除去乙烷中的乙烯:通入酸性高锰酸钾溶液中 |
|
| 8. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数值,下列说法不正确的是 A. 10 g D216O中所含中子数为5NA B. 标准状况下,22.4 L乙烷中所含共价键数目为7NA C. 7.8g Na2O2中所含阴、阳离子总数目为0.4NA D. 密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA |
|
| 9. 选择题 | 详细信息 | ||||||||||||||||||
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断下列叙述正确的是
|
|||||||||||||||||||
| 10. 选择题 | 详细信息 |
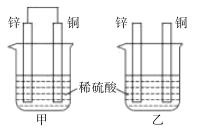
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是 A. ①②中Mg作负极、③④中Fe作负极 B. ②中A1作负极,电极反应式为2A1-6e-=2Al3+ C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ D. ④中Cu作正极,电极反应式为O2+4e-+2H2O=4OH- |
|
| 11. 选择题 | 详细信息 |
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是 A. b极发生氧化反应 B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O C. 放电时,电流从a极经过负载流向b极 D. 其中的离子交换膜需选用阳离子交换膜 |
|
| 12. 选择题 | 详细信息 |
|
由葡萄糖(C6H12O6)、乙酸(CH3COOH)和甲醛(HCHO)组成的混合物240 g,在一定条件下完全燃烧,生成H2O的质量是 A. 36 g B. 48 g C. 72 g D. 144 g |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||
一定温度下,10 mL 0.40 mol/LH2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
|
|||||||||||||||||
| 14. 选择题 | 详细信息 |
|
一定条件下,在一恒容密闭容器中,下列能表示反应:X(g)+2Y(g) ①X、Y、Z的物质的量之比为1:2:2;②Y的消耗速率与Z的消耗速率相等;③容器中的压强不再发生变化;④单位时间内生成n mol Z的同时消耗nmol Y A. ①② B. ①④ C. ③④ D. ②③ |
|
| 15. 选择题 | 详细信息 |
|
标准状况下,44.8L CH4与一定量Cl2在光照条件下发生取代反应,待反应完全后,测得四种有机取代产物的物质的量相等,则消耗的Cl2为( ) A. 1mol B. 2 mol C. 4mol D. 5 mol |
|
| 16. 选择题 | 详细信息 |
|
下列不能说明氯元素的非金属性比硫元素的强的有几项( ) ①HCl 比H2S 稳定 ②S2-还原性比Cl-强 ③Cl2 能与H2S 反应生成 S ④HCl 的溶解度比H2S 大 ⑤相同条件下Cl2 与 Fe 反应生成FeCl3,S 与Fe 生成FeS ⑥HC1 的酸性比 H2S 强 A.2 项 B.3 项 C.4 项 D.5 项 |
|
| 17. 选择题 | 详细信息 |
|
乙烯直接水合法制乙醇因污染小而应用于工业合成,下列有关说法错误的是( ) A. 该反应属于加成反应 B. 乙烯能使酸性KMnO4溶液褪色 C. 乙烷中含有少量乙烯,可用H2除去 D. 等物质的量的乙烯与乙醇充分燃烧,耗氧量相同 |
|
| 18. 选择题 | 详细信息 |
|
下列实验装置或操作能达到实验目的的是 ( ) A. 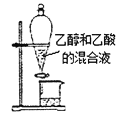 分离乙醇和乙酸 B. 分离乙醇和乙酸 B.  制取乙酸乙酯 C. 制取乙酸乙酯 C. 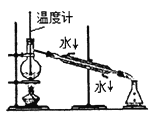 石油的蒸馏 D. 石油的蒸馏 D. 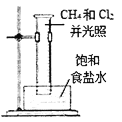 甲烷与氯气反应 甲烷与氯气反应 |
|
| 19. 选择题 | 详细信息 |
|
某校学生用化学知识解决生活中的问题。下列家庭小实验中不合理的是 A.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 B.用高度白酒进行皮肤消毒 C.用食用碱(Na2CO3)溶液洗涤餐具上的油污 D.用米汤(含淀粉)检验加碘盐中的碘酸钾(KIO3) |
|
| 20. 选择题 | 详细信息 |
|
苯环结构中不存在碳碳单键与碳碳双键的交替结构,下列可以作为证据的是( ) ①苯不能与溴水反应而褪色 ②苯不能使酸性KMnO4溶液褪色 ③苯在一定条件下既能发生取代反应,又能发生加成反应 ④经测定,邻二甲苯只有一种结构 ⑤苯分子具有正六边形结构 A. ①②④⑤ B. ①③④⑤ C. ①②③④ D. ②③④⑤ |
|
| 21. 选择题 | 详细信息 |
|
某混合物由乙酸和乙酸乙酯按一定比例组成,其中氢元素的质量分数为 A. 40% B. 60% C. 64% D. 72% |
|
| 22. 选择题 | 详细信息 |
工业上以浓缩海水为原料提取溴的部分流程如图:下列说法正确的是( ) A.海水需要浓缩,是因为海水中的Br2 含量较低 B.热空气的作用是将多余的 Cl2 吹出 C.吸收塔中发生的反应是 3Br2+3CO D.反应釜 2 中发生的反应是 5Br-+BrO |
|
| 23. 选择题 | 详细信息 |
|
下列属于物理变化的有( )个 ①石油的分馏 ②煤的干馏 ③石油的裂化 ④铝热反应 ⑤由乙烯制备聚乙烯⑥将氧气转化为臭氧 ⑦乙烯催熟果实 ⑧将苯加入溴水中 ⑨海水蒸馏制取淡水 A.1 B.2 C.3 D.4 |
|
| 24. 填空题 | 详细信息 | |||||||||||||||||||||||||||
(1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________。 (2)部分短周期主族元素的原子半径及主要化合价
|
||||||||||||||||||||||||||||
| 25. 实验题 | 详细信息 |
海带中含有碘元素。某实验小组设计了如下实验流程,通过实验证明海带中存在碘元素,并从海带中提取出碘单质。 根据实验流程回答下列各题: (1)步骤①中灼烧所用到硅酸盐材质的仪器,除酒精灯外还有______。 (2)步骤③的操作名称为______。 (3)经过步骤③以后,所得滤液中主要含有可溶性的无机盐:氯化钠、硫酸钠、碘化钠等。为了将I-变为碘单质,可加入经硫酸酸化的双氧水氧化,写出该反应的离子方程式______。检验步骤④是否成功的方法是______。 (4)步骤⑤操作名称是______。 (5)为了进一步制得纯净的碘单质,可以通过步骤⑥实现,实验装置如下图所示。 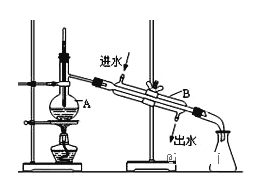 已知实验中得到的粗碘为碘的CCl4溶液,CCl4的沸点76.8℃、I2的沸点184.4℃。 ①指出图中错误的地方并改正______。 ②锥形瓶中先收集到的物质是______。 |
|
| 26. 综合题 | 详细信息 |
A是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。以A原料衍生出部分化工产品的反应流程如下(部分反应条件已略去):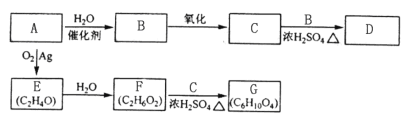 已知:①2RCHO+O2 ②R-CH=CH-OH烯醇式的结构不能稳定存在。 请回答下列问题: (1)A的电子式为______。 (2)B、D分子中的官能团名称分别是______、______。 (3)C和B反应生成D的化学方程式为___________,该反应的类型为_____________。 (4)E的结构简式为_________。 (5)结合题意,写出E可能的同分异构体的结构简式__________。 (6)F和C反应生成G的化学方程式为_________。 |
|
| 27. | 详细信息 | ||||||||||||||
I. 在2L密闭容器内,800℃时反应 2NO(g)+O2 (g)⇌2NO2 (g)体系中,n(NO) 随时间的变化如表:
|
|||||||||||||||