йқҷе®ҒеҺҝ第дёҖдёӯеӯҰеҗҢжӯҘз»ғд№
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺ科еӯҰгҖҒжҠҖжңҜгҖҒзӨҫдјҡгҖҒзҺҜеўғеҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—жңүе…іиҜҙжі•й”ҷиҜҜзҡ„жҳҜ( ) A.з„°зҒ«дёӯе‘ҲзҺ°зҡ„з»ҡдёҪиүІеҪ©пјҢжҳҜз”ұйҮ‘еұһе…ғзҙ зҡ„з„°иүІеҸҚеә”еҪўжҲҗзҡ„ B.ж°Ҝж°”гҖҒжҳҺзҹҫжҳҜж°ҙеӨ„зҗҶиҝҮзЁӢдёӯеёёз”Ёзҡ„дёӨз§ҚеҢ–еӯҰиҜ•еүӮпјҢдәҢиҖ…зҡ„дҪңз”ЁеҺҹзҗҶзӣёеҗҢ C.е·ҘдёҡдёҠз”ЁFeCl3жә¶ж¶ІжқҘи…җиҡҖй“ңиҶңпјҢеҲ¶дҪңеҚ°еҲ·з”өи·Ҝжқҝ D.иЈ…иҝҗд№ҷйҶҮзҡ„еҢ…иЈ…з®ұдёҠеә”иҙҙдёҠжҳ“зҮғж¶ІдҪ“еҚұйҷ©е“Ғж Үеҝ— |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
зҺ°жңүеӣӣз»„еҲҶж•Јзі»пјҡв‘ жұҪжІ№е’Ңж°ҙеҪўжҲҗзҡ„д№іжөҠж¶ІгҖҒв‘Ўеҗ«жңүжіҘжІҷзҡ„йЈҹзӣҗж°ҙгҖҒв‘ўжә¶жңүзўҳ(I2)зҡ„зўҳеҢ–й’ҫжә¶ж¶ІгҖҒв‘Јд№ҷдәҢйҶҮе’ҢдёҷдёүйҶҮзҡ„ж··еҗҲжә¶ж¶І(д№ҷдәҢйҶҮе’ҢдёҷдёүйҶҮзҡ„йғЁеҲҶзү©зҗҶжҖ§иҙЁи§ҒиЎЁ)гҖӮ
иҜ·з”ЁеҰӮеӣҫжүҖзӨәзҡ„д»ӘеҷЁеҲҶзҰ»д»ҘдёҠеҗ„ж··еҗҲж¶ІпјҢд»ӘеҷЁе’Ңж–№жі•дёҚиғҪеҜ№еә”зҡ„жҳҜ( ) |
||||||||||||||||
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( ) A.2.4gйҮ‘еұһй•ҒжүҖеҗ«з”өеӯҗж•°зӣ®дёә0.2NA B.16gCH4жүҖеҗ«еҺҹеӯҗж•°зӣ®дёәNA C.еңЁиҝҮж°§еҢ–й’ дёҺж°ҙзҡ„еҸҚеә”дёӯпјҢжҜҸз”ҹжҲҗ0.1molж°§ж°”пјҢиҪ¬з§»з”өеӯҗзҡ„ж•°зӣ®дёә0.2NA D.ж ҮеҮҶзҠ¶еҶөдёӢпјҢ2.24LCCl4дёӯеҗ«ж°ҜеҺҹеӯҗж•°зӣ®дёә0.4NA |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗҢжё©еҗҢеҺӢдёӢпјҢзӯүиҙЁйҮҸзҡ„дёӢеҲ—ж°”дҪ“жүҖеҚ жңүзҡ„дҪ“з§ҜжңҖеӨ§зҡ„жҳҜ A.N2 B.CO2 C.HCl D.CH4 |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ A.зЁҖзЎ«й…ёдёҺй“ҒзІүеҸҚеә”пјҡ2Fe + 6H+ = 2Fe3+ + 3H2вҶ‘ B.ж°ўж°§еҢ–й’Ўжә¶ж¶ІдёҺзЁҖзЎ«й…ёеҸҚеә”пјҡBa2+ + SO C.зЎ«й…ёй“ңжә¶ж¶ІдёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”пјҡCu2+ + 2OHпјҚ= Cu(OH)2вҶ“ D.еңЁдёҖе®ҡйҮҸзҡ„Ca(HCO3)2ж»ҙеҠ иҝҮйҮҸNaOHжә¶ж¶ІпјҡOHпјҚ+ HCO |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е®Ӣд»Ји‘—еҗҚжі•еҢ»еӯҰ家е®Ӣж…Ҳзҡ„гҖҠжҙ—еҶӨйӣҶеҪ•гҖӢдёӯжңүвҖң银й’ҲйӘҢжҜ’вҖқзҡ„и®°иҪҪпјҢвҖң银й’ҲйӘҢжҜ’вҖқзҡ„еҺҹзҗҶжҳҜ4Ag+2H2S+O2=2X+2H2OгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( ) A.Xзҡ„еҢ–еӯҰејҸдёәAgS B.银й’ҲйӘҢжҜ’ж—¶пјҢз©әж°”дёӯж°§ж°”еӨұеҺ»з”өеӯҗ C.еҸҚеә”дёӯAgе’ҢH2SеқҮжҳҜиҝҳеҺҹеүӮ D.жҜҸз”ҹжҲҗ1 mol XпјҢеҸҚеә”иҪ¬з§»2 mol e- |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
дёӢеҲ—еҗ„з»„зү©иҙЁпјҢдёҚиғҪжҢүеҰӮеӣҫ(вҖңвҶ’вҖқиЎЁзӨәеҸҚеә”дёҖжӯҘе®ҢжҲҗ)е…ізі»иҪ¬еҢ–зҡ„жҳҜ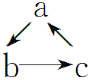
|
|||||||||||||||||||||
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іе®һйӘҢзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. йҷӨеҺ»ж°§еҢ–й“Ғдёӯж··жңүзҡ„е°‘йҮҸж°§еҢ–й“қпјҢеҸҜеҠ е…ҘиҝҮйҮҸзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІпјҢе®Ңе…ЁеҸҚеә”еҗҺпјҢиҝҮж»Ө B. дёәжөӢе®ҡзҶ”иһҚж°ўж°§еҢ–й’ зҡ„еҜјз”өжҖ§пјҢеҸҜеңЁз“·еқ©еҹҡдёӯзҶ”еҢ–ж°ўж°§еҢ–й’ еӣәдҪ“еҗҺиҝӣиЎҢжөӢйҮҸ C. еҲ¶еӨҮFe(OH)3иғ¶дҪ“пјҢйҖҡеёёжҳҜе°ҶFe(OH)3еӣәдҪ“жә¶дәҺзғӯж°ҙдёӯ D. еҸҜз”Ёжҫ„жё…зҹізҒ°ж°ҙйүҙеҲ«Na2CO3жә¶ж¶Іе’ҢNaHCO3жә¶ж¶І |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізү©иҙЁзҡ„жҖ§иҙЁдёҺз”ЁйҖ”пјҢдёҚе…·жңүеҜ№еә”е…ізі»зҡ„жҳҜ( ) A.Na2O2дёәж·Ўй»„иүІеӣәдҪ“пјҢеҸҜз”ЁдәҺжҪңиүҮдёӯзҡ„дҫӣж°§еүӮ B.Na2CO3жә¶ж¶ІжҳҫзўұжҖ§пјҢеҸҜз”ЁдәҺйҷӨеҷЁзҡҝиЎЁйқўзҡ„жІ№жұЎ C.A12O3зҡ„зҶ”зӮ№й«ҳпјҢеёёз”ЁдҪңиҖҗзҒ«гҖҒиҖҗй«ҳжё©жқҗж–ҷ D.ж°Ҝж°ҙе…·жңүејәж°§еҢ–жҖ§пјҢFe2+еңЁж°Ҝж°ҙдёӯиғҪиў«ж°§еҢ–жҲҗFe3+ |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®ӨйҮҢйңҖиҰҒ240 mL 0.1 molВ·LпјҚ1зҡ„зЎ«й…ёй“ңжә¶ж¶ІпјҢзҺ°йҖүеҸ–250 mLе®№йҮҸ瓶иҝӣиЎҢй…ҚеҲ¶пјҢд»ҘдёӢеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. з§°еҸ–4.0 gж— ж°ҙзЎ«й…ёй“ңпјҢеҠ ж°ҙ250 mL B. з§°еҸ–6.25 gиғҶзҹҫпјҢеҠ ж°ҙ250 mL C. з§°еҸ–3.84 gж— ж°ҙзЎ«й…ёй“ңпјҢй…ҚжҲҗ250 mLжә¶ж¶І D. з§°еҸ–4.0 gж— ж°ҙзЎ«й…ёй“ңпјҢй…ҚжҲҗ250 mLжә¶ж¶І |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ( ) в‘ еёёжё©дёӢpH=11зҡ„жә¶ж¶Ідёӯпјҡ в‘ЎеҠ е…Ҙй“қзІүиғҪж”ҫеҮә в‘ўж— иүІйҖҸжҳҺгҖҒй…ёжҖ§жә¶ж¶Ідёӯпјҡ в‘Јеҗ«жңүеӨ§йҮҸ A.в‘ в‘Ў B.в‘ в‘ўв‘Ј C.в‘ D.в‘Ўв‘ў |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
дёәдәҶжҺўз©¶HClгҖҒH2CO3е’ҢH2SiO3зҡ„й…ёжҖ§ејәејұпјҢжҹҗеӯҰз”ҹи®ҫи®ЎдәҶеҰӮеӣҫжүҖзӨәзҡ„е®һйӘҢиЈ…зҪ®пјҢеёҢжңӣйҖҡиҝҮдёҖж¬Ўе®һйӘҢиҫҫеҲ°е®һйӘҢзӣ®зҡ„пјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ( )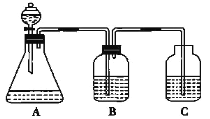 A.й”ҘеҪўз“¶дёӯеҸҜд»Ҙзӣӣж”ҫNa2CO3 B.иЈ…зҪ®Bдёӯзҡ„зӣ®зҡ„жҳҜйҷӨеҺ»жҢҘеҸ‘зҡ„HCl C.иЈ…зҪ®Cзҡ„зӣ®зҡ„жҳҜе°ҫж°”еӨ„зҗҶ D.иҜҘиЈ…зҪ®еҸҜд»Ҙеҫ—еҮәHClгҖҒH2CO3гҖҒH2SiO3зҡ„й…ёжҖ§ејәејұйЎәеәҸ |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
SO2ж°”дҪ“дёҺи¶ійҮҸFe2(SO4)3жә¶ж¶Іе®Ңе…ЁеҸҚеә”еҗҺпјҢеҶҚеҠ е…ҘK2Cr2O7жә¶ж¶ІпјҢиҜҘиҝҮзЁӢеҸ‘з”ҹеҰӮдёӢдёӨдёӘеҢ–еӯҰеҸҚеә”пјҡв‘ SO2пјӢ2Fe3пјӢпјӢ2H2Oпјқ A.ж°§еҢ–жҖ§пјҡ B. C.еҸҚеә”в‘ЎдёӯжҜҸ0.5 mol K2Cr2O7еҸӮеҠ еҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣ®дёә6NA D.иӢҘжңү6.72 L(ж ҮеҮҶзҠ¶еҶө)SO2еҸӮеҠ еҸҚеә”пјҢеҲҷжңҖз»Ҳж¶ҲиҖ—0.1 mol K2Cr2O7 |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
дёӢеҲ—е®һйӘҢзҺ°иұЎжҸҸиҝ°жӯЈзЎ®зҡ„жҳҜ( )
A.A B.B C.C D.D |
||||||||||||||||
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁзЎ«й…ёжә¶ж¶ІдёӯпјҢNaClO3е’ҢNa2SO3иғҪжҢүзү©иҙЁзҡ„йҮҸд№ӢжҜ”1пјҡ2е®Ңе…ЁеҸҚеә”пјҢз”ҹжҲҗдёҖз§ҚжЈ•й»„иүІж°”дҪ“XпјҢеҗҢж—¶Na2SO3иў«ж°§еҢ–дёәNa2SO4пјҢеҲҷXдёәпјҲ пјү A.Cl2 B.Cl2O7 C.ClO2 D.Cl2O |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
жҹҗеҗҢеӯҰйҮҮз”ЁзЎ«й“Ғзҹҝз„ҷзғ§еҸ–зЎ«еҗҺзҡ„зғ§жёЈ(дё»иҰҒжҲҗеҲҶдёәFe2O3гҖҒSiO2гҖҒAl2O3пјҢдёҚиҖғиҷ‘е…¶д»–жқӮиҙЁ)еҲ¶еҸ–дёғж°ҙеҗҲзЎ«й…ёдәҡй“Ғ(FeSO4В·7H2O)пјҢи®ҫи®ЎдәҶеҰӮдёӢжөҒзЁӢпјҡ дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү A. жә¶и§Јзғ§жёЈйҖүз”Ёи¶ійҮҸзЎ«й…ёпјҢиҜ•еүӮXйҖүз”Ёй“ҒзІү B. еӣәдҪ“1дёӯдёҖе®ҡеҗ«жңүSiO2пјҢжҺ§еҲ¶pHжҳҜдёәдәҶдҪҝAl3+иҪ¬еҢ–дёәAl(OH)3пјҢиҝӣе…ҘеӣәдҪ“2 C. д»Һжә¶ж¶І2еҫ—еҲ°FeSO4В·7H2Oдә§е“Ғзҡ„иҝҮзЁӢдёӯпјҢйЎ»жҺ§еҲ¶жқЎд»¶йҳІжӯўе…¶ж°§еҢ–е’ҢеҲҶи§Ј D. иӢҘж”№еҸҳж–№жЎҲпјҢеңЁжә¶ж¶І1дёӯзӣҙжҺҘеҠ NaOHиҮіиҝҮйҮҸпјҢеҫ—еҲ°зҡ„жІүж·Җз”ЁзЎ«й…ёжә¶и§ЈпјҢе…¶жә¶ж¶Із»Ҹз»“жҷ¶еҲҶзҰ»д№ҹеҸҜеҫ—еҲ°FeSO4В·7H2O |
|
| 17. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңүдёӢеҲ—еҚҒз§Қзү©иҙЁпјҡ в‘ 0.1mol/LзЎ«й…ёв‘Ўе°ҸиӢҸжү“в‘ўзәҜзўұв‘ЈдәҢж°§еҢ–зўів‘Өи‘Ўиҗ„зі–в‘Ҙ0.1mol/LNaOHжә¶ж¶Ів‘ҰSiO2⑧氨ж°ҙв‘ЁAl2O3в‘©зЎ«й…ёй“Ғжә¶ж¶І (1)дёҠиҝ°еҚҒз§Қзү©иҙЁдёӯеұһдәҺйқһз”өи§ЈиҙЁзҡ„жңү___(еЎ«еәҸеҸ·)гҖӮ (2)жңүдёӨз§Қзү©иҙЁеңЁж°ҙжә¶ж¶ІдёӯеҸҜеҸ‘з”ҹеҸҚеә”пјҢзҰ»еӯҗж–№зЁӢејҸдёәпјҡH++OH-=H2OпјҢиҝҷдёӨз§Қзү©иҙЁзҡ„еәҸеҸ·жҳҜ___(еЎ«еәҸеҸ·)гҖӮ (3)ж—ўиғҪи·ҹзӣҗй…ёеҸҚеә”еҸҲиғҪи·ҹNaOHжә¶ж¶ІеҸҚеә”зҡ„жҳҜ___(еЎ«еәҸеҸ·)гҖӮ (4)ж ҮеҮҶзҠ¶еҶөдёӢпјҢ___Lв‘Јдёӯеҗ«жңү0.4molж°§еҺҹеӯҗгҖӮ (5)в‘ҘдёҺв‘Ұжә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә___гҖӮ (6)зЎ…жҳҜдҝЎжҒҜжҠҖжңҜзҡ„е…ій”®жқҗж–ҷпјҢеҶҷеҮәе·ҘдёҡдёҠз”Ёв‘ҰеҲ¶еӨҮзІ—зЎ…зҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸ___гҖӮ (7)еңЁCu+2H2SO4(жө“) |
|
| 18. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEдә”з§Қзү©иҙЁзҡ„з„°иүІеҸҚеә”йғҪжҳҫй»„иүІпјҢAгҖҒBдёҺж°ҙеҸҚеә”йғҪжңүж°”дҪ“ж”ҫеҮәпјҢAдёҺж°ҙзҡ„еҸҚеә”ж”ҫеҮәзҡ„ж°”дҪ“еҸӘе…·жңүж°§еҢ–жҖ§пјҢеҗҢж—¶йғҪз”ҹжҲҗжә¶ж¶ІCпјҢCдёҺе°‘йҮҸзҡ„CO2еҸҚеә”з”ҹжҲҗDпјҢDжә¶ж¶ІдёҺиҝҮйҮҸзҡ„CO2еҸҚеә”з”ҹжҲҗEпјҢEеҠ зғӯиғҪеҸҳжҲҗDгҖӮ пјҲ1пјүеҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„еҢ–еӯҰејҸпјҡA____________гҖҒC____________гҖҒE_____________гҖӮ пјҲ2пјүBдёҺж°ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜпјҡ______________________________________________гҖӮ пјҲ3пјүDжә¶ж¶ІдёӯйҖҡе…ҘCO2зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ__________________________________________гҖӮ пјҲ4пјү7.8gзҡ„AеҠ е…ҘеҲ°и¶ійҮҸзҡ„зЎ«й…ёй“ңжә¶ж¶ІдёӯпјҢж ҮеҶөдёӢпјҢдә§з”ҹж°”дҪ“зҡ„дҪ“з§Ҝдёә________L, з”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸдёә________gгҖӮ |
|
| 19. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
жҹҗиҜҫеӨ–жҙ»еҠЁе°Ҹз»„ж¬ІеҲ¶еҸ–ж¬Ўж°Ҝй…ёй’ е’Ңж°ҜеҢ–й’ жә¶ж¶ІпјҢдёәжҸҗй«ҳж¬Ўж°Ҝй…ёй’ еҗ«йҮҸпјҢз”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®гҖӮеӣҫдёӯд»ӘеҷЁAдёӯзӣӣжө“зӣҗй…ёпјҢ瓶д№ҷзӣӣйҘұе’ҢйЈҹзӣҗж°ҙпјҢ瓶дёҷзӣӣжө“зЎ«й…ёпјҢдёҒдёӯзӣӣNaOHжә¶ж¶ІгҖӮ(жҚ®иө„ж–ҷжҳҫзӨәпјҡCl2дёҺNaOHеңЁдёҚеҗҢжё©еәҰдёӢпјҢдә§зү©дёҚеҗҢгҖӮеңЁиҫғй«ҳжё©еәҰдёӢжҳ“з”ҹжҲҗNaClO3) еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)д»ӘеҷЁAзҡ„еҗҚз§°жҳҜ___гҖӮ (2)еҶҷеҮәиЈ…зҪ®з”ІдёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ___гҖӮеҶҷеҮәиЈ…зҪ®дёҒдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ___гҖӮ (3)жңүеҗҢеӯҰи®ӨдёәеҸҜд»ҘзңҒеҺ»д№ҷиЈ…зҪ®пјҢдҪ и®ӨдёәиғҪеҗҰзңҒеҺ»д№ҷиЈ…зҪ®пјҹ___(еЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқ)пјҢзҗҶз”ұжҳҜпјҡ___гҖӮ (4)иҜҘе®һйӘҢиЈ…зҪ®еӯҳеңЁдёҖдёӘйқһеёёеӨ§зҡ„жјҸжҙһпјҢдҪ и®ӨдёәжҳҜд»Җд№Ҳпјҹ___гҖӮ (5)дёҒиЈ…зҪ®дёӯеҶ°ж°ҙзҡ„дҪңз”ЁжҳҜпјҡ___гҖӮ (6)жңүеҗҢеӯҰжҸҗеҮәиҝҳеҸҜд»Ҙз”ЁеҸҰдёҖз§Қж–№жі•еҲ¶еҸ–ж¬Ўж°Ҝй…ёй’ жә¶ж¶Іпјҡеҗ‘Na2CO3жә¶ж¶ІдёӯеҠ е…ҘCa(ClO)2пјҢеҸҚеә”еҗҺиҝҮж»ӨгҖӮиҜҘж–№жі•дёҺ第дёҖз§Қж–№жі•зӣёжҜ”пјҢдјҳзӮ№йҷӨж— еүҜеҸҚеә”еҸ‘з”ҹеӨ–пјҢиҝҳжңүпјҡ___гҖӮ (7)з”Ёй…ёжҖ§й«ҳй”°й…ёй’ҫе’Ңжө“зӣҗй…ёд№ҹеҸҜд»ҘеҲ¶еӨҮж°Ҝж°”пјҢ2KMnO4+16HCl(жө“)=2KCl+2MnCl2+5Cl2вҶ‘+8H2OпјҢеҪ“жңү7.9gKMnO4е®Ңе…ЁеҸҚеә”ж—¶пјҢз”ҹжҲҗж°Ҝж°”зҡ„дҪ“з§Ҝдёә__LгҖӮ(ж ҮеҮҶзҠ¶еҶөдёӢ) (8)еҲ¶еӨҮзҡ„ж¬Ўж°Ҝй…ёй’ жә¶ж¶ІдёҚиғҪе’ҢдёҖз§Қй…ёжҖ§жё…жҙҒеүӮе…ұеҗҢдҪҝз”ЁпјҢеҗҰеҲҷдјҡеј•иө·дёӯжҜ’пјҢиҜ·иҜҙжҳҺеҺҹеӣ ___(з”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨә) |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
жҹҗеӨ§еһӢеҢ–е·ҘеҺӮдә§з”ҹзҡ„й…ёжҖ§еәҹж¶Ідёӯеҗ«жңүдёӨз§ҚйҮ‘еұһзҰ»еӯҗпјҡFe3+гҖҒCu2+пјҢеҢ–еӯҰе°Ҹз»„и®ҫи®ЎдәҶеҰӮеӣҫжүҖзӨәзҡ„ж–№жЎҲеҜ№еәҹж¶ІиҝӣиЎҢеӨ„зҗҶпјҢд»Ҙеӣһ收йҮ‘еұһпјҢдҝқжҠӨзҺҜеўғгҖӮ (1)ж“ҚдҪңв‘ зҡ„еҗҚз§°жҳҜ___пјӣ (2)еҶҷеҮәж“ҚдҪңв‘ иҝҮзЁӢдёӯпјҢFe3+дёҺй“Ғеұ‘еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ___пјӣ (3)жә¶ж¶ІAдёӯеҠ е…Ҙи¶ійҮҸH2O2жә¶ж¶Ізҡ„зӣ®зҡ„жҳҜе°Ҷжә¶ж¶ІAдёӯзҡ„Fe2+е®Ңе…ЁиҪ¬еҢ–дёәFe3+пјҢеңЁжӯӨиҝҮзЁӢдёӯH2O2жүҖиө·зҡ„дҪңз”ЁжҳҜ___пјӣ(A.ж°§еҢ–еүӮ B.иҝҳеҺҹеүӮ) еҶҷеҮәиҜҘиҝҮзЁӢзҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ___гҖӮ (4)жЈҖйӘҢжә¶ж¶ІBдёӯеҗ«жңүзҡ„йҮ‘еұһйҳізҰ»еӯҗзҡ„е®һйӘҢж–№жі•дёәпјҡеҸ–е°‘йҮҸжә¶ж¶ІBдәҺжҙҒеҮҖзҡ„е°ҸиҜ•з®ЎдёӯпјҢеҠ е…Ҙ___иҜ•еүӮпјҢжә¶ж¶Іиҝ…йҖҹиҪ¬еҸҳдёәзәўиүІпјҢеҚіеҸҜжЈҖйӘҢгҖӮ (5)H2O2гҖҒд№ҷйҶҮгҖҒNaClOзӯүж°ҙжә¶ж¶ІеҸҜз”ЁдәҺзҒӯжҙ»ж–°еһӢеҶ зҠ¶з—…жҜ’пјҢH2O2зҒӯиҸҢеҺҹзҗҶдёҺ___зӣёеҗҢгҖӮ A.д№ҷйҶҮ B.NaClO |
|
- 2018е№ҙиҮі2019е№ҙй«ҳдәҢдёӢжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲе®үеҫҪзңҒй»„еұұеёӮеұҜжәӘ第дёҖдёӯеӯҰпјү
- й»‘йҫҷжұҹй«ҳдёҖеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2018е№ҙдёҠеҚҠе№ҙпјүж— зәёиҜ•еҚ·
- 2019-2020е№ҙй«ҳдәҢ9жңҲжңҲиҖғеҢ–еӯҰдё“йўҳи®ӯз»ғпјҲеҗүжһ—зңҒеҗүеҢ–第дёҖй«ҳзә§дёӯеӯҰж Ўпјү
- з”ҳиӮғзңҒеј жҺ–еёӮ2020-2021е№ҙй«ҳдәҢдёҠеҶҢжңҹжң«еӯҰдёҡж°ҙе№іиҙЁйҮҸжЈҖжөӢеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 5.2.1 ж°®ж°”дёҺж°®зҡ„еӣәе®ҡдёҖж°§еҢ–ж°®е’ҢдәҢж°§еҢ–ж°®--й«ҳдёҖеҢ–еӯҰдёҠеҶҢиҜҫж—¶з»ғд№ жЁЎжӢҹиҖғиҜ•з»ғд№
- й»‘йҫҷжұҹ2019е№ҙй«ҳдәҢеҢ–еӯҰдёӢжңҹжңҲиҖғжөӢйӘҢзҪ‘з»ңиҖғиҜ•иҜ•еҚ·
- е№ҝиҘҝйҳІеҹҺжёҜеёӮ2020-2021е№ҙй«ҳдёҖдёҠжңҹжңҹдёӯжөӢиҜ•еҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- еҗүжһ—2019е№ҙй«ҳдёҖеҢ–еӯҰдёҠжңҹжңҹдёӯиҖғиҜ•иҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ