2019-2020年高二9月月考化学专题训练(吉林省吉化第一高级中学校)
| 1. 选择题 | 详细信息 |
|
下列物质的水溶液能导电,但属于非电解质的是( ) A.CH3COOH B.Cl2 C.NH4HCO3 D.NH3 |
|
| 2. 选择题 | 详细信息 |
|
在化学反应A(g)+3B(g) A.v(A)=v(B) B.v(A)=2v(C) C.3v(B)=v(C) D.v(B)=3v(D) |
|
| 3. 选择题 | 详细信息 |
|
在2 L的密闭容器中,发生以下反应:2A(g)+B(g) A.3.4 mol B.3.2 mol C.2.8 mol D.1.2 mol |
|
| 4. 选择题 | 详细信息 |
|
对于反应2SO2(g)+O2(g) A. 通入大量O2 B. 增大容器容积 C. 移去部分SO3 D. 降低体系温度 |
|
| 5. 选择题 | 详细信息 |
|
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ①X、Y、Z的物质的量之比是1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y A. ①② B. ①④ C. ②③ D. ③④ |
|
| 6. 选择题 | 详细信息 |
|
对于X+Y A. X为液态,Z为气态 B. X为固态,Z为气态 C. X为气态,Z为气态 D. 无法确定 |
|
| 7. 选择题 | 详细信息 |
|
在一密闭烧瓶中,25 ℃时存在着平衡:2NO2(g) ①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度 A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤ |
|
| 8. 选择题 | 详细信息 |
|
下列叙述中,一定能判断化学平衡移动的是 A. 混合物中各组分的浓度改变 B. 正、逆反应速率改变 C. 混合物中各组分的百分含量改变 D. 混合体系的压强改变 |
|
| 9. 选择题 | 详细信息 |
|
对于可逆反应:2SO2(g)+O2(g) A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2 |
|
| 10. 选择题 | 详细信息 |
|
将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) A. 升高温度,X的体积分数减小 B. 增大压强(缩小容器体积),Z的浓度不变 C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 D. 保持容器体积不变,充入一定量的Z,X的体积分数增大 |
|
| 11. 选择题 | 详细信息 |
|
在密闭容器中发生反应m A(g)+n B(g) A. m+n>p B. 平衡向逆反应方向移动 C. A的转化率提高 D. C的体积分数增加 |
|
| 12. 选择题 | 详细信息 |
|
已知某温度下,K(HCN)=6.2×10-10、K(HF)=6.8×10-4、K(CH3COOH)=1.8×10-5、K(HNO2)=6.4×10-6。物质的量浓度都为0.1 mol/L的下列溶液中,c(H+)浓度由大到小的次序是( ) A.HCN>HNO2>CH3COOH>HF B.HF>CH3COOH>HNO2>HCN C.HCN>CH3COOH>HF>HNO2 D.CH3COOH>HCN>HF>HNO2 |
|
| 13. 选择题 | 详细信息 |
|
醋酸的下列性质中,可以证明它是弱电解质的是( ) ①1 mol/L的醋酸溶液中c(H+)=0.01 mol/L②醋酸以任意比与水互溶③10 mL 1mol/L的醋酸溶液恰好与10 mL 1 mol/L的NaOH溶液完全反应④在相同条件下,醋酸溶液的导电性比盐酸弱 A.④ B.①③④ C.①④ D.②④ |
|
| 14. 选择题 | 详细信息 |
|
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y A. 33% B. 40% C. 50% D. 65% |
|
| 15. 选择题 | 详细信息 |
已知某可逆反应m A(g)+n B(g) 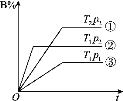 A.T1<T2 p1>p2 m+n>p 放热反应 B.T1>T2 p1<p2 m+n>p 吸热反应 C.T1<T2 p1>p2 m+n<p 放热反应 D.T1>T2 p1<p2 m+n<p 吸热反应 |
|
| 16. 选择题 | 详细信息 | ||||||||||||
已知某化学反应的平衡常数表达式为K=
|
|||||||||||||
| 17. 选择题 | 详细信息 |
|
已知下列反应的平衡常数:①H2(g)+S(s) A. K1+K2 B. K1-K2 C. K1×K2 D. K1/K2 |
|
| 18. 选择题 | 详细信息 |
|
一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g) ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度 A. ①②④ B. ②③ C. ②③④ D. 全部 |
|
| 19. 选择题 | 详细信息 |
|
下列说法正确的是 A. 非自发进行的反应一定不能发生 B. 自发进行的反应一定能迅速发生 C. 在一定条件下,非自发进行的反应也能发生 D. 吸热反应一定不能自发进行 |
|
| 20. 选择题 | 详细信息 |
反应 C(s)+ H2O (g)  A.CO的体积分数最高的一段时间为t5-t6 B.t2-t3和t3-t4时间段H2的体积分数相等 C.t1时刻改变的条件是降低温度 D.t4-t5时间段平衡向正反应方向移动 |
|
| 21. 选择题 | 详细信息 |
|
在1 L的密闭容器中,发生反应4A(s)+3B(g) A. 用A表示的反应速率是0.4 mol·L-1·min-1 B. 用BCD分别表示反应的速率,其比值是3∶2∶1 C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1 D. 在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大 |
|
| 22. 选择题 | 详细信息 |
如图所示是关于反应A2(g)+B2(g) 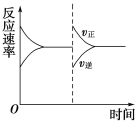 A. 升高温度,同时加压 B. 压强不变,降低温度 C. 压强、温度不变,充入一些与之不反应的惰性气体 D. 温度、压强不变,充入一些A2(g) |
|
| 23. 填空题 | 详细信息 |
|
现有物质①硫酸铜晶体 ②碳酸钙固体 ③纯磷酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧固态苛性钾 ⑨氨水 ⑩熟石灰固体 ⑪液态HCl ⑫液态CH3COOH,按下列要求填空。 (1)属于强电解质的是_________________________(填序号,下同); (2)属于弱电解质的是________________________; (3)属于非电解质的是________________________; (4)既不是电解质,又不是非电解质的是________; (5)能导电的是____________________________。 |
|
| 24. 填空题 | 详细信息 |
|
现有反应:mA(g)+nB(g) (1)该反应的逆反应为________反应(填“吸热”或“放热”),且m+n________p(填“>”、“=”或“<”)。 (2)减压使容器体积增大时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同) (3)若加入B(维持体积不变),则A的转化率____________。 (4)若升高温度,则平衡时B、C的浓度之比将____________。 (5)若加入催化剂,平衡时气体混合物的总物质的量__________。 |
|
| 25. 填空题 | 详细信息 |
|
二氧化氮是重要的氧化剂,存在如下平衡: 2NO2(g) (1)已知:2NO2(g) A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度 (2)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L﹣1、c(N2O4)=0.0120mol·L﹣1,反应2NO2(g) |
|
| 26. 综合题 | 详细信息 | |||||||||||||||||||||
|
工业上通常采用N2(g)和H2(g)催化成NH3(g):N2(g)+3H2(g) (1)在一定温度下,若将10amol N2和30amol H2放入2 L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10amol N2、20amol H2和20amol NH3,判断平衡移动的方向是______(填“正向移动”“逆向移动”或“不移动”)。 (2)若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3达到平衡时浓度的范围为_____;若平衡时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3起始时浓度的范围为_____。 (3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表: 容,测得反应达到平衡时的有关数据如表:
|
||||||||||||||||||||||
| 27. 综合题 | 详细信息 |
|
工业上可由水煤气合成甲醇。 (1)还可以通过下列反应制备甲醇:CO(g)+2H2(g) 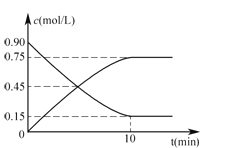 (2)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。 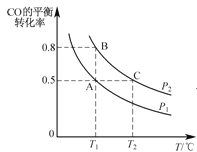 ①下列说法不能判断该反应达到化学平衡状态的是_________。(填字母) A.H2的消耗速率等于CH3OH的生成速率的2倍 B.H2的体积分数不再改变 C.体系中H2的转化率和CO的转化率相等 D.体系中气体的平均摩尔质量不再改变 ②比较A、B两点压强大小PA_PB(填“>、<、=”). ③若达到化学平衡状态A时,容器的体积为20 L,如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积V(B)=__L。 |
|
最近更新



