天津市南开中学2020届高三第二次月考化学专题训练
| 1. 选择题 | 详细信息 |
|
下列有关物质性质与用途具有对应关系的是( ) A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂. B.ClO2具有还原性,可用于自来水的杀菌消毒 C.Al2O3 具有两性,可用于电解冶炼铝 D.NH3易溶于水,可用作制冷剂 |
|
| 2. 选择题 | 详细信息 |
|
室温下,下列各组离子在指定溶液中能大量共存的是 A. 0.1 mol·L−1NaOH溶液:Na+、K+、 B. 0.1 mol·L−1FeCl2溶液:K+、Mg2+、 C. 0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH− D. 0.1 mol·L−1H2SO4溶液:K+、 |
|
| 3. 选择题 | 详细信息 |
|
下列化学方程式中,不能正确表达反应颜色变化的是 A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4 B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2 C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2 D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3 |
|
| 4. 选择题 | 详细信息 |
|
X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是 A. 熔点:X的氧化物比Y的氧化物高 B. 热稳定性:X的氢化物大于Z的氢化物 C. X与Z可形成离子化合物ZX D. Y的单质与Z的单质均能溶于浓硫酸 |
|
| 5. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) ①常温常压下,l7g甲基(—l4CH3) 中所含的中子数为9 NA ②常温常压下,6.4gCu 与40 mL 10mol·L-1浓HNO3作用,产生NO2分子的数目为0.2 NA ③1.6g甲烷中含有的C -H键数目为0.1 NA ④某温度时,1 LpH=6的纯水中含有1.0×10-6NA个H+ ⑤7.8g ⑥20 g氖气中所含的原子数目为NA ⑦25℃时,pH= 12的NaOH溶液中含有OH- 的数目为0.01 NA ⑧通常状态下,H3O+和OH- 各1mol含有的电子数均为10 NA A.①②⑦ B.④⑥⑧ C..②④⑦ D.②⑥⑧ |
|
| 6. 选择题 | 详细信息 |
科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是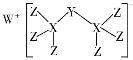 A. WZ的水溶液呈碱性 B. 元素非金属性的顺序为X>Y>Z C. Y的最高价氧化物的水化物是中强酸 D. 该新化合物中Y不满足8电子稳定结构 |
|
| 7. 选择题 | 详细信息 | |||||||||||||||
下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
|
||||||||||||||||
| 8. 选择题 | 详细信息 |
|
下列有关金属及其化合物的不合理的是( ) A. 将废铁屑加入 B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业 C. 盐碱地(含较多 D. 无水 |
|
| 9. 选择题 | 详细信息 |
|
下列物质的转化在给定条件下能实现的是( ) ①Al2O3 ②S ③饱和NaCl(aq) ④Fe2O3 ⑤MgCl2(aq) A. ②③④ B. ①③⑤ C. ②④⑤ D. ①④⑤ |
|
| 10. 选择题 | 详细信息 |
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系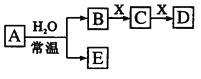 A.若X是 B.若A是单质,B和D的反应是 C.若D为CO,C能和E反应,则A一定为 D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐 |
|
| 11. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A.NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=2:1时, B.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,铁元素在溶液中主要以Fe2+形式存在 C.AlCl3 溶液与烧碱溶液反应,当体积比为1:4时,铝元素恰好以 D.CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=2:3时,能得到澄清溶液 |
|
| 12. 选择题 | 详细信息 |
|
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I- (忽略水的电离),Cl-、Br-、I- 的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为 A.7:4 B.7:3 C.7:2 D.7:1 |
|
| 13. | 详细信息 |
下表中的实线表示元素周期表的部分边界。①-⑨分别表示元素周期表中对应位置的元素。 (1)请在上表中用实线补全元素周期表边界_____。画出①~⑨元素中电负性最强元素的原子的价电子排布图:_____________________________。 (2)⑥和⑦的最高价氧化物的水化物中酸性较强的是_________________(填名称),元素②③可以形成原子个数比为1 : 1的负一价阴离子,其电子式为________________(己知各原子满足稳定结构)。 (3)写出工业制取元素⑤单质的化学反应方程式:________________________________;请写出实验室制取③的简单气态氢化物的化学反应方程式:_______________________。 (4)元素①、③、⑦可组成多种化合物,其中一种化合物既含离子键又含共价键,且水溶液呈酸性,用离子方程式解释其水溶液呈酸性的原因:______________________________。 (5)元素④和⑨可以形成原子个数之比为1 : 1的化合物A,向硫酸亚铁溶液中加入A生成红褐色沉淀,若反应后溶液中氢氧化钾和硫酸钾的质量比为56:87,写出对应的离子方程式:________________________________。 |
|
| 14. | 详细信息 |
|
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题: (1)元素As与N同族。预测As的氢化物分子的立体结构为__________________,其沸点比NH3的____________(填 “高”或“低”),其判断理由是________________________。 (2)Fe 成为阳离子时首先失去_____________轨道电子。 (3)比较离子半径:F- ______O2- (填“大于”“等于”或“小于”)。 (4)晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。与K紧邻的O个数为________。在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于__________位置,O处于_________________位置。  |
|
| 15. 实验题 | 详细信息 |
凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,再通过滴定测量。已知:NH3 + H3BO3 =NH3·H3BO3;NH3·H3BO3 + HCl = NH4Cl + H3BO3。 回答下列问题: (1)a的作用是___________________________。 (2)b中放入少量碎瓷片的目的是____________ 。f的名称是_______________。 (3)清洗仪器: g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是________________________________________。打开k2放掉水,重复操作2~3次。 (4)仪器清洗后,g中加入硼酸(H3BO3) 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。 ①d中保留少量水的目的是____________________________。 ②e中主要反应的离子方程式为.____________________________________________,e采用中空双层玻璃瓶的作用是___________________________________。 (5)取某甘氨酸(C2H5NO2) 样品m g进行测定,滴定g中吸收液时消耗浓度为c mol·L-1的盐酸VmL,则样品中氮的质量分数为__________________________(不需化简),选择指示剂为____________________。 |
|
最近更新



