高一上册第二阶段考试化学免费试题带答案和解析(2018-2019年福建省泰宁第一中学)
| 1. 选择题 | 详细信息 |
|
在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( ) A.1:1 B.2:1 C.1:2 D.3:2 |
|
| 2. 选择题 | 详细信息 |
|
实验室里需用480mL 0.1mol•L﹣1的碳酸钠溶液,选取500mL容量瓶进行配制,以下操作正确的是 A. 称取5.1gNa2CO3,加入500mL水 B. 称取13.7gNa2CO3·10H2O,配成500mL溶液 C. 称取5.3Na2CO3,加入500mL水 D. 称取14.3gNa2CO3·10H2O,配成500mL溶液 |
|
| 3. 选择题 | 详细信息 |
|
下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-浓度相等的是( ) A. 150mL 3mol•L-1的KCl溶液 B. 75mL 2.5mol•L-1的CaCl2溶液 C. 150mL 3mol•L-1KClO3溶液 D. 25mL 2mol•L-1的FeCl3溶液 |
|
| 4. 选择题 | 详细信息 |
|
关于胶体的叙述错误的是 A.溶液显电中性,胶体带有电荷,所以胶体较稳定 B.胶体粒子能透过滤纸,但不能透过半透膜,所以可用渗析的的方法精制胶体 C.可用丁达尔效应区分溶液和胶体 D.电泳实验说明了胶体粒子能吸附溶液中的阳离子或阴离子而带有电荷 |
|
| 5. 选择题 | 详细信息 |
|
在下列各溶液中,离子一定能大量共存的是 A.强酸性溶液中:K+、Al3+、Cl-、 B.含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、 C.含有0.1 mol•L-1Ca2+的溶液中:Na+、K+、 D.室温下,pH=1的溶液中:Na+、Fe2+、 |
|
| 6. 选择题 | 详细信息 |
如图,A处通入Cl2,关闭B阀时,C中的湿润红色布条看不到明显变化;打开B阀后,C中的湿润红色布条逐渐褪色。则D瓶中盛放的是 A.浓盐酸 B.饱和NaCl溶液 C.浓硫酸 D.NaOH溶液 |
|
| 7. 选择题 | 详细信息 |
|
下列化合物依次属于酸、碱、盐、氧化物的一组是 A. B. C. D.HBr KOH |
|
| 8. 选择题 | 详细信息 |
|
某溶液中含有较大量的Cl-、 ①滴加足量的Mg(NO3)2溶液;②过滤;③滴加适量的AgNO3溶液;④滴加足量的Ba(NO3)2溶液 A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②① |
|
| 9. 选择题 | 详细信息 |
|
阿伏加德罗常数的值为NA,下列叙述中错误的是 ①标准状况下,2.24 L水中含有0.1 NA个水分子 ②常温常压下,32g SO2 含有的分子数约为3.01×1023 ③2 mol NaOH的摩尔质量为80g/mol ④H2的气体摩尔体积约为22.4L/mol ⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol ⑥2mol/L的CaCl2溶液中Cl-的数目为4NA ⑦常温常压下,1mol氦气含有的原子数为NA ⑧11.2 L氯气中含有 NA个氯原子 A.①③④⑥⑧ B.①④⑤⑥⑧ C.①②④⑥⑧ D.②③④⑤⑦ |
|
| 10. 选择题 | 详细信息 |
|
有关铁的化合物的说法中,错误的是 A. FeO不稳定,在空气中加热迅速被氧化成 B.  由图示操作可制取 由图示操作可制取C. D. |
|
| 11. 选择题 | 详细信息 |
|
某电解质溶液中有有Na+、Mg2+、Cl-、SO42-,且Na+、Mg2+、Cl-的浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则SO42-的物质的量浓度为( ) A.0.1mol/L B.0.2mol/L C.0.3mol/L D.0.4mol/L |
|
| 12. 选择题 | 详细信息 |
|
己知在碱性溶液中可发生如下反应: 2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( ) A. +3 B. +4 C. +5 D. +6 |
|
| 13. 选择题 | 详细信息 |
|
下列溶液中分别加入足量的铁粉,充分作用后,溶液中的阳离子总物质的量明显减少,该溶液是 A.CuCl2 B.HCl C.FeCl3 D.AlCl3 |
|
| 14. 选择题 | 详细信息 |
|
已知有如下反应:① 2BrO3-+ Cl2 ═ Br2 + 2ClO3-,② 2FeCl3 + 2KI ═ 2FeCl2 + 2KCl + I2,③ ClO3-+ 5Cl-+ 6H+ ═ 3Cl2 + 3H2O,④ 2FeCl2 + Cl2 ═ 2FeCl3,下列各微粒氧化能力由强到弱的顺序正确的是 A.ClO3- > BrO3- > Cl2 > Fe3+ > I2 B.BrO3- > Cl2 > ClO3- > I2 > Fe3+ C.BrO3- > ClO3- > Fe3+ > Cl2 > I2 D.BrO3- > ClO3- > Cl2 > Fe3+ > I2 |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||||
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )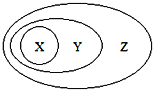
|
|||||||||||||||||||||
| 16. 选择题 | 详细信息 |
|
根据化学方程式:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( ) A. Br-、Fe2+、I- B. I-、Fe2+、Br- C. Br2、Fe3+、I2 D. Br-、I-、Fe2+ |
|
| 17. 选择题 | 详细信息 |
|
能在无色溶液中大量共存的一组离子是 A.H+、Na+、Cl-、 C.H+、K+、 |
|
| 18. 选择题 | 详细信息 |
|
下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是 A.Cu(OH)2+HCl;Cu(OH)2+CH3COOH B.NaHCO3+H2SO4;Na2CO3+HCl C.NaHSO4+NaOH;H2SO4+NaOH D.BaCl2+H2SO4;Ba(OH)2+H2SO4 |
|
| 19. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是( ) A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ B. BaCO3溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ C. 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3﹣═CaCO3↓+2H2O+CO32﹣ D. 向Ca(HCO3)2溶液中加入过量的 NaOH溶液:Ca2++2HCO3﹣+2OH﹣═CaCO3↓+CO32﹣+2H2O |
|
| 20. 选择题 | 详细信息 |
|
已知W2、X2、Y2、Z2四种物质的氧化能力Z2>X2>W2>Y2,判断下列氧化还原反应能发生的是 A.2W-+Z2→2z-+W2 B.2X-+W2→2W-+X2 C.2X-+Y2→2Y-+X2 D.2Z-+X2→2X-+Z2 |
|
| 21. 填空题 | 详细信息 |
|
今有10种物质:①Na ②稀硝酸 ③纯醋酸 ④NH3 ⑤空气 ⑥CO2 ⑦Fe(OH)3胶体 ⑧NaCl晶体 ⑨BaCO3 ⑩碘酒 (1)能导电的物质______;(用序号填空,下同) (2)电解质,但熔融状态下并不导电______. (3)强电解质_______; (4)非电解质_______; (5)区分Fe(OH)3胶体和FeCl3溶液实验方法______; (6)实验室中①通常保存在_______中; (7)写出②和⑨反应的离子方程式_______. (8)向Fe(OH)3胶体中逐滴滴入过量的盐酸,会出现一系列变化:先出现___________,原因:________,随后________,原因________(用离子方程式表示)。 |
|
| 22. 计算题 | 详细信息 |
|
i.完成该化学方程式:KClO3+HCl(浓) →KCl+ ClO2↑+ Cl2↑+H2O_____________。 ii.用2.7g铝和过量200mL浓度为2mol/L的盐酸反应,回答下列问题: (1)反应消耗_______mol HCl; (2)在标准状况下产生的气体体积为_______升; (3)溶液中生成物的物质的量浓度为________。(假设反应后溶液体积不变) |
|
| 23. 实验题 | 详细信息 |
|
配制0.1mol/L盐酸溶液460mL。 A、在盛盐酸的烧杯中注入适量蒸馏水,用玻璃棒搅拌,使其混匀。 B、待稀释的盐酸冷却后,沿玻璃棒注入_______中。 C、用量筒量取密度为1.19g/cm3质量分数为36.5%的浓盐酸约____ mL注入烧杯中。 D、用蒸馏水洗涤烧杯、玻璃棒2~3次,将洗涤液注入容量瓶中。 E、往容量瓶中小心加蒸馏水至液面接近刻度线________处,改用_______蒸馏水,使溶液凹液面最低点恰好与刻度线相切。 回答下列问题: (1)请将正确操作顺序用字母表示__________。 (2)待稀释的盐酸冷却后,沿玻璃棒注入________中。 (3)用量筒量取密度为1.19g/cm3质量分数为36.5%的浓盐酸约_____mL注入烧杯中。 (4)往容量瓶中小心加蒸馏水至液面接近刻度线______处,改用______蒸馏水,使溶液凹液面最低点恰好与刻度线相切。 (5)制过程中,其他操作都是正确的,下列操作会引起误差偏高的是_________。 A、用量筒量取浓盐酸俯视观察凹液面 B、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 C、将烧杯、玻璃棒和量筒洗涤2-3次,并将洗涤液也注入容量瓶 D、搅拌过程中有液体溅出,会使最终结果 E、定容时俯视刻度线相 F、容量瓶不干燥,含有少量蒸馏水 G、使用前用0.1mol/L盐酸洗涤容量瓶 |
|
| 24. | 详细信息 |
已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。  (1)写出A、C、F、G的化学式:A_______;C______;F_____;G_____。 (2)保存C溶液时要加固体A的原因是(用离子方程式解释)______。 (3)写出C→D的离子方程式_________。 (4)写出E→F的化学方程式:________。 |
|
最近更新



