2019-2020年高一上半年期末考试化学试卷(宁夏吴忠中学)
| 1. 选择题 | 详细信息 |
|
在实验室中,对下列事故或药品的处理正确的是( ) A.有Cl2泄漏时,用NaOH溶液浸湿软布蒙面,迅速离开现场 B.金属Na着火燃烧时,用泡沫灭火器灭火 C.浓硫酸沾在皮肤上,立即用Na2CO3溶液冲洗 D.实验室做完实验剩余的金属钠要放回原试剂瓶 |
|
| 2. 选择题 | 详细信息 |
|
中华民族有着光辉灿烂的历史,下列有关描述不涉及氧化还原反应的是( ) A. 用胆矾湿法炼铜 B. 用铁矿石高炉炼铁 C. “爆竹声中一岁除,春风送暖入屠苏” D. 只要功夫深,铁杵磨成针 |
|
| 3. 选择题 | 详细信息 |
|
在自然界中,既有以游离态形式存在,又有以化合态形式存在的元素是( ) A. 硫 B. 硅 C. 氯 D. 铝 |
|
| 4. 选择题 | 详细信息 |
|
设NA代表阿伏加德罗常数,下列说法正确的是( ) A.含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2 B.常温常压下,16gO2所含的电子数为8NA C.标准状况下,22.4LSO3中所含的SO3分子数为NA D.78gNa2O2与足量水充分反应时电子转移数为2NA |
|
| 5. 选择题 | 详细信息 |
|
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( ) A.KClO3在反应中得到电子 B.ClO2是氧化产物 C.H2C2O4在反应中被还原 D.1mol KClO3参加反应有2 mol电子转移 |
|
| 6. 选择题 | 详细信息 |
|
关于物质的用途下列说法正确的是( ) ①水玻璃是制备硅胶和木材防火剂的原料;②氧化铝可以用做耐火材料;③氢氟酸可以用来刻蚀玻璃;④纯净的二氧化硅是制备光导纤维的原料;⑤利用氯气的毒性可以消灭田鼠;⑥漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂;⑦四氧化三铁常用作红色油漆和涂料⑧晶体硅是良好的半导体材料,可以制成光电池 A.①②③④⑤⑥ B.①②③④⑤⑥⑧ C.①②④⑤⑥⑦ D.③④⑤⑥⑦ |
|
| 7. 选择题 | 详细信息 |
|
一定条件下,当溶液中XO4-与H2O2分子个数比恰好为2︰5时,溶液中XO4-离子被还原为 较低价态,则X元素的化合价变为 A. +2 B. +3 C. +4 D. +5 |
|
| 8. 选择题 | 详细信息 |
|
下列实验现象与对应化学方程式都正确的是( ) A.向Na2SiO3溶液中加入稀盐酸,边加边振荡,有硅酸胶体产生;Na2SiO3+2HCl=H2SiO3+2NaCl B.氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2 C.FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色;2Fe(OH)2+O2+H2O=2Fe(OH)3 D.钠投入水中,浮在水面熔成小球,在水面快速移动,得到的溶液显碱性;2Na+2H2O=2NaOH+H2↑ |
|
| 9. 选择题 | 详细信息 |
|
下列鉴别方法不能达到实验目的的是( ) A.用丁达尔效应鉴别淀粉溶液和氯化钠溶液 B.用焰色反应鉴别碳酸氢钠和碳酸钠两种无色溶液 C.用品红溶液鉴别SO2和CO2两种无色气体 D.用NaOH溶液鉴别硫酸铝和硫酸镁两种无色溶液 |
|
| 10. 选择题 | 详细信息 |
|
下列化合物不能由两种单质直接化合而生成的是( ) A.FeC12 B.Cu2S C.Mg3N2 D.Na2O2 |
|
| 11. 选择题 | 详细信息 |
|
下列各组离子在溶液中一定能够大量共存的是( ) A.在强酸性溶液中:K+、HCO3-、SO42-、ClO- B.在含有大量OH-的溶液中:NO3-、Na+、Cl-、AlO2- C.在含有大量SO42-的无色溶液中:Ba2+、Na+、Cu2+、Cl- D.在含有大量Fe2+的溶液中:H+、Na+、Cl-、ClO- |
|
| 12. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.H2S、SO2、CO2三种气体都可用浓硫酸干燥 B.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 C.Al2O3和MgO均可与NaOH溶液反应 D.SO2气体通入Ba(NO3)2溶液可得到BaSO4沉淀 |
|
| 13. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是( ) A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag B.碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO2↑+H2O C.金属铝加入到浓碱溶液中:2Al+2OH-=2AlO2-+3H2↑ D.铜粉加入到氯化铁溶液中:Cu+2Fe3+=Cu2++2Fe2+ |
|
| 14. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色 B.pH在5.6~7之间的降水通常称为酸雨 C.合金的硬度一般比成分金属的大 D.硫粉在过量的纯氧中燃烧可生成SO3 |
|
| 15. 选择题 | 详细信息 |
|
下列物质的变化,不能通过一步化学反应完成的是( ) A.Na2O2→Na2CO3 B.SO2→H2 SO4 C.SiO2→Na2SiO3 D.SiO2→H2SiO3 |
|
| 16. 选择题 | 详细信息 |
|
向50mL18mol·L-1的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是( ) A.等于0.9mol B.大于0.45mol,小于0.9mol C.等于0.45mol D.小于0.45mol |
|
| 17. 选择题 | 详细信息 |
|
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是 A.向饱和Na2CO3溶液中通入过量的CO2 B.向NaAlO2溶液中逐滴加入过量的稀盐酸 C.向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液 D.向Fe(OH)3胶体中逐滴加入过量的稀盐酸 |
|
| 18. 选择题 | 详细信息 |
|
下列四种有色溶液与SO2气体作用均能褪色,其实质相同的是 ①酸性高锰酸钾溶液 ②品红溶液 ③溴水 ④滴有酚酞的氢氧化钠溶液 A. ①③ B. ②③ C. ①④ D. ②④ |
|
| 19. 选择题 | 详细信息 |
|
下列有关焰色反应及其操作的说法正确的是 A. 焰色反应是化学变化 B. Na与NaCl在灼烧时火焰颜色相同 C. 铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验 D. 用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+ |
|
| 20. 选择题 | 详细信息 |
|
两种金属混合粉末15g,与足量的盐酸反应时生成11.2L H2(标况下),符合上述情况的金属混合物是( ) A. Mg、Fe B. Zn、Ag C. Fe、Zn D. Mg、Al |
|
| 21. 选择题 | 详细信息 |
|
加热5g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为 A.3.38g B.4.58g C.4.16g D.4.41g |
|
| 22. | 详细信息 |
|
下列各种物质既能与强酸反应,又能与强碱反应的是( ) ①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3 A. ①③⑤ B. ②③④ C. ①③④ D. ①④⑤ |
|
| 23. 选择题 | 详细信息 |
|
证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是( ) ①先滴加氯水,再滴加KSCN溶液后显红色 ②先滴加KSCN溶液,不显红色,再滴加氯水后显红色 ③滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色 ④只需滴加KSCN溶液 A.①② B.②③ C.③④ D.①④ |
|
| 24. 选择题 | 详细信息 |
|
实验室用MnO2和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得Cl2全部用石灰水吸收,可制得漂白粉的质量是 A. 14.3 g B. 25.4 g C. 28.6 g D. 50.8 g |
|
| 25. 选择题 | 详细信息 |
|
取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为 A. 1:6 B. 2:3 C. 3:2 D. 1:1 |
|
| 26. 填空题 | 详细信息 |
|
有下列四个反应:①2Na+2H2O=2NaOH +H2↑;②2Na2O2+2H2O=4NaOH+O2↑;③2F2+2H2O=4HF+O2;④2H2O (1)水只做氧化剂的是__; (2)水只做还原剂的是__; (3)水既做氧化剂又做还原剂的是__; (4)水既不做氧化剂又不做还原剂的是__ |
|
| 27. 填空题 | 详细信息 |
|
(1)除去Na2CO3粉末中混入的NaHCO3杂质用__方法,化学方程式为__。 (2)除去氧化铜粉末中混入的氧化铝粉末通常用__试剂,离子方程式为__。 |
|
| 28. 推断题 | 详细信息 |
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。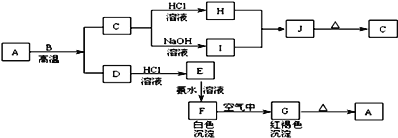 请回答下列问题 (1)写出下列物质的化学式A___,E___。 (2)F在空气中转化为G的化学方程式:__。 (3)A和B反应的化学方程式:___。 (4)H和I生成J的离子方程式:___。 (5)如何检验E中大量存在的阳离子?__ |
|
| 29. 填空题 | 详细信息 |
将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题: (1)写出OA段和BC段反应的离子方程式: OA:___________ ; BC:_____________; (2)原Mg-Al合金的质量是_____________。 (3)原HCl溶液的物质的量浓度是________________。 (4)所加NaOH溶液的物质的量浓度是____________。 |
|
| 30. 实验题 | 详细信息 |
用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。 回答下列问题: (1)写出在A中发生反应的化学方程式为:__; (2)B中选用的试剂是__,其作用是__; (3)E中选用的试剂是__,其作用是__; (4)若用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是__。 |
|
| 31. 实验题 | 详细信息 |
某同学为了检验浓硫酸与木炭粉在加热条件下反应:C+2H2SO4(浓)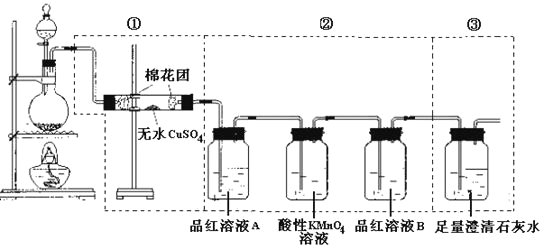 (1)①中无水硫酸铜的作用是___。 (2)②中酸性KMnO4溶液的作用是__。 (3)②中两次用到品红溶液,A的作用是___,B的作用分别是___。 |
|
最近更新



