йҷ•иҘҝзңҒжёӯеҚ—еёӮеӨ§иҚ”еҺҝ2020-2021е№ҙй«ҳдёҖеүҚеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
дёӢеҲ—е®һйӘҢиЈ…зҪ®зҡ„йҖүжӢ©жӯЈзЎ®зҡ„жҳҜ
|
|||||||||||||
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰеңЁз”ҹжҙ»дёӯжңүзқҖе№ҝжіӣзҡ„еә”з”ЁпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A.е…үеҜјзәӨз»ҙзҡ„дё»иҰҒжҲҗеҲҶжҳҜжҷ¶дҪ“зЎ… B.з”Ёй“ҒжЎ¶еҸҜд»ҘиЈ…жө“зЎ«й…ё C.иҮӘжқҘж°ҙеҸҜд»Ҙз”Ёж°Ҝж°”жқҘжқҖиҸҢгҖҒж¶ҲжҜ’ D.зўій…ёй’ еҸҜз”ЁдәҺеҺ»йҷӨйӨҗе…·зҡ„жІ№жұЎ |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№еҢ–еӯҰжҰӮеҝөзҡ„зІҫеҮҶзҗҶи§ЈжҳҜеӯҰеҘҪеҢ–еӯҰзҡ„еүҚжҸҗжқЎд»¶пјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A.й…ёжҖ§ж°§еҢ–зү©дёҖе®ҡжҳҜйқһйҮ‘еұһж°§еҢ–зү© B.йҮ‘еұһеҚ•иҙЁеңЁеҢ–еӯҰеҸҚеә”дёӯеҢ–еҗҲд»·дёҖе®ҡеҚҮй«ҳпјҢеҸ‘з”ҹж°§еҢ–еҸҚеә” C.жҹҗе…ғзҙ д»ҺеҢ–еҗҲжҖҒеҸҳдёәжёёзҰ»жҖҒпјҢиҜҘе…ғзҙ дёҖе®ҡиў«иҝҳеҺҹ D.еҮЎжҳҜдёҚиғҪеҜјз”өзҡ„зү©иҙЁдёҖе®ҡжҳҜйқһз”өи§ЈиҙЁ |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
A.22.4L(ж ҮеҮҶзҠ¶еҶө)ж°®ж°”дёӯеҗ«жңү7 NAдёӘз”өеӯҗ B.0.1 C.1mol D.16gж°§ж°”е’ҢиҮӯж°§зҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүNAдёӘж°§еҺҹеӯҗ |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁж°ҙжә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ A. C. |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—дёүдёӘеҸҚеә”еқҮиғҪе®Ңе…ЁеҸ‘з”ҹпјҡ A.ж°§еҢ–жҖ§пјҡ C. |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
100mLзү©иҙЁзҡ„йҮҸжө“еәҰдёәb A.жә¶ж¶Ідёӯеҗ«жә¶иҙЁзҡ„иҙЁйҮҸдёәag B.еҜҶеәҰдёә C.жә¶ж¶Ідёӯеҗ«жңүеҫ®зІ’зҡ„жҖ»ж•°зӣ®дёә0.2 D.е°ҶдҪ“з§Ҝдёә2.2bLзҡ„ж°ҜеҢ–ж°Ҝж°”дҪ“йҖҡе…Ҙ100mLж°ҙдёӯеҚіеҸҜжҲҗb |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізү©иҙЁеҲҶзұ»жҲ–еҪ’зұ»жӯЈзЎ®зҡ„дёҖз»„жҳҜ в‘ ж¶Іж°ҜгҖҒе№ІеҶ°гҖҒзўҳзӣҗеқҮдёәеҢ–еҗҲзү© в‘Ўж°Ҝж°ҙгҖҒзӣҗй…ёгҖҒж°ҙзҺ»з’ғеқҮдёәж··еҗҲзү© в‘ўжҳҺзҹҫгҖҒе°ҸиӢҸжү“гҖҒзәҜзўұеқҮдёәз”өи§ЈиҙЁ в‘ЈзүӣеҘ¶гҖҒиұҶжөҶгҖҒзҹізҒ°ж°ҙеқҮдёәиғ¶дҪ“ в‘Ө A.в‘ в‘Ў B.в‘Ўв‘ў C.в‘ўв‘Ј D.в‘Ўв‘ўв‘Ө |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҪ¬еҢ–е…ізі»дёҚжӯЈзЎ®зҡ„жҳҜ A. B. C. D. |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—и§ЈйҮҠдәӢе®һзҡ„еҢ–еӯҰз”ЁиҜӯдёӯпјҢжӯЈзЎ®зҡ„жҳҜ A.е·ҘдёҡеҲ¶зІ—зЎ…пјҡ 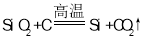 B.еёёжё©дёӢпјҢеҗ‘й“ңзүҮдёӯж»ҙеҠ жө“зЎ«й…ёпјҡ C.й“қзүҮж”ҫе…ҘNaOHжә¶ж¶Ідёӯпјҡ D.еҺ»йҷӨзўій…ёй’ дёӯж··жңүзҡ„е°‘йҮҸзўій…ёж°Ҝй’ пјҡ |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘ж°ҜеҢ–й“өжә¶ж¶ІдёӯеҠ е…ҘвҖң84ж¶ҲжҜ’ж¶ІвҖқеҸ‘з”ҹзҰ»еӯҗеҸҚеә”дёәпјҡ A.иҜҘеҸҚеә”зҡ„иҝҳеҺҹеүӮжҳҜClO- B.ж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә3пјҡ2 C. |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
дёӢеҲ—е®һйӘҢиЈ…зҪ®(еӨ№жҢҒиЈ…зҪ®е·ІзңҒз•Ҙ)иҝӣиЎҢзҡ„зӣёеә”е®һйӘҢпјҢиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜ A.й…ёжҖ§ B.жә¶ж¶ІеҸҳдёәиЎҖзәўиүІпјҢиҜҙжҳҺ C.иҜ•з®Ўдёӯе……ж»Ўжә¶ж¶ІпјҢиҜҙжҳҺйҖҡе…Ҙж°§ж°”зҡ„дҪ“з§Ҝдёә D.дёҠдёӢжҢҜиҚЎе®№йҮҸ瓶пјҢиғҪдҪҝй…ҚеҲ¶зҡ„NaClжә¶ж¶Іж··еҗҲеқҮеҢҖ |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
жҹҗе®һйӘҢе°Ҹз»„еҗҢеӯҰйңҖиҰҒзәҜеҮҖзҡ„ж°ҜеҢ–й’ жә¶ж¶ІпјҢдҪҶжҳҜе®һйӘҢе®Өзҡ„ж°ҜеҢ–й’ ж ·е“Ғдёӯж··жңүе°‘йҮҸзЎ«й…ёй’ пјҢиҜҘе®һйӘҢе°Ҹз»„еҗҢеӯҰи®ҫи®ЎеҰӮеӣҫжүҖзӨәе®һйӘҢж–№жЎҲпјҡ дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A. C.ж“ҚдҪңxдёәиҝҮж»Ө D.иҜ•еүӮbж—ўеҸҜд»ҘжҳҜзӣҗй…ёеҸҲеҸҜд»ҘжҳҜзЎ«й…ё |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
дёӢеҲ—вҖңе®һйӘҢж“ҚдҪңеҸҠзҺ°иұЎвҖқдёҺвҖңе®һйӘҢз»“и®әвҖқеқҮзӣёз¬Ұзҡ„дёҖз»„жҳҜ
|
||||||||||||||||
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®дёӢеҲ—е®һйӘҢдәӢе®һеҫ—еҮәзҡ„зӣёеә”з»“и®әпјҢжӯЈзЎ®зҡ„жҳҜ A.ж°ҜеҢ–й“өеҠ зғӯж—¶иғҪдә§з”ҹ B. C.и”—зі–дёӯж»ҙе…Ҙжө“зЎ«й…ёдјҡзӮӯеҢ–пјҢеҲҷзәёзүҮдёҠж»ҙе…Ҙжө“зЎ«й…ёд№ҹдјҡзӮӯеҢ– D. |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жңүAlгҖҒCuOгҖҒ A.0.4 molвҲҷLвҲ’1 B.0.8 molвҲҷLвҲ’1 C.1.2 molвҲҷLвҲ’1 D.1.6 molвҲҷLвҲ’1 |
|
| 17. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
дёӢеӣҫжүҖзӨәзҡ„иЈ…зҪ®жҳҜеҢ–еӯҰе®һйӘҢдёӯеёёи§Ғж··еҗҲзү©еҲҶзҰ»е’ҢжҸҗзәҜзҡ„ж–№жі•пјҢд№ҹжҳҜеӯҰз”ҹеә”е…·еӨҮзҡ„е®һйӘҢеҹәжң¬жҠҖиғҪгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳ(еЎ«д»ЈиЎЁиЈ…зҪ®еӣҫзҡ„еӯ—жҜҚ)пјҡ (1)д»Һж°ҜеҢ–й’ҫжә¶ж¶Ідёӯеҫ—еҲ°ж°ҜеҢ–й’ҫеӣәдҪ“пјҢйҖүжӢ©______иЈ…зҪ®гҖӮ (2)ж°ҜеҢ–й’ еӣәдҪ“дёӯж··жңүзўҳпјҢйҖүжӢ©______иЈ…зҪ®гҖӮ (3)жІіж°ҙж ·е“ҒдёӯеҠ дәҶе°‘йҮҸжҳҺзҹҫпјҢйҖүжӢ©______иЈ…зҪ®гҖӮ (4)йҷӨеҺ»иҮӘжқҘж°ҙдёӯзҡ„ (5)иЈ…зҪ®EеңЁеҲҶж¶Іж—¶дёәдҪҝж¶ІдҪ“йЎәеҲ©ж»ҙдёӢпјҢйҷӨжү“ејҖжҙ»еЎһеӨ–пјҢиҝҳеә”иҝӣиЎҢзҡ„е…·дҪ“ж“ҚдҪңжҳҜ______гҖӮ |
|
| 18. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІйҖҸжҳҺжә¶ж¶ІдёӯеҸҜиғҪеӨ§йҮҸеӯҳеңЁзҰ»еӯҗдёә (1)дёҚеҒҡд»»дҪ•е®һйӘҢе°ұеҸҜд»ҘзЎ®е®ҡеҺҹжә¶ж¶ІдёӯдёҚеӯҳеңЁзҡ„зҰ»еӯҗжҳҜ______гҖӮ (2)еҸ–е°‘йҮҸжә¶ж¶ІпјҢеҠ е…ҘиҝҮйҮҸзӣҗй…ёпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјӣеҶҚеҠ е…ҘиҝҮйҮҸзЁҖзЎқй…ёпјҢжІүж·ҖдёҚж¶ҲеӨұгҖӮж №жҚ®жӯӨзҺ°иұЎдҪ еҫ—еҮәзҡ„з»“и®әжҳҜ______гҖӮ (3)еҸ–(2)дёӯзҡ„ж»Өж¶ІпјҢеҠ е…ҘиҝҮйҮҸзЁҖж°Ёж°ҙпјҢеҮәзҺ°зҷҪиүІжІүж·ҖпјҢиҜҙжҳҺеҺҹжә¶ж¶ІдёӯиӮҜе®ҡеӯҳеңЁзҡ„зҰ»еӯҗжҳҜ______гҖӮз”ҹжҲҗзҷҪиүІжІүж·Җзҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ______гҖӮ (4)еҺҹжә¶ж¶ІдёӯдёҖе®ҡеҗ«жңүзҡ„зҰ»еӯҗжңү______пјӣеҸҜиғҪеӯҳеңЁзҡ„зҰ»еӯҗжңү______гҖӮ |
|
| 19. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е·Ҙдёҡй”…зӮүй•ҝжңҹз…®зғ§дјҡеҪўжҲҗй”…еһў(дё»иҰҒжҲҗеҲҶ (1)й…ҚеҲ¶зЁҖзӣҗй…ёж—¶жүҖз”ЁзҺ»з’ғд»ӘеҷЁйҷӨйҮҸзӯ’гҖҒзғ§жқҜе’ҢзҺ»з’ғжЈ’еӨ–пјҢиҝҳйңҖиҰҒзҡ„д»ӘеҷЁжңү______гҖӮ (2)йңҖиҰҒз”ЁйҮҸзӯ’еҸ–12.0 (3)дёӢеҲ—ж“ҚдҪңдјҡеҜјиҮҙжүҖй…Қзӣҗй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰеҒҸдҪҺзҡ„жҳҜ______(еЎ«еӯ—жҜҚеәҸеҸ·)гҖӮ A.зЁҖйҮҠзҡ„зӣҗй…ёиҪ¬з§»еҲ°е®№йҮҸ瓶дёӯжңӘжҙ—ж¶Өзғ§жқҜ B.е®ҡе®№ж—¶дҝҜи§Ҷж¶Ійқў C.ж‘ҮеҢҖеҗҺеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢдәҺжҳҜеҠ ж°ҙиҮіеҲ»еәҰзәҝ D.й…ҚеҲ¶еүҚе®№йҮҸ瓶дёӯжңүе°‘йҮҸж°ҙ (4)еҶҷеҮәз”ЁжүҖй…Қзҡ„зЁҖзӣҗй…ёеҺ»йҷӨж°ҙеһўдёӯ |
|
| 20. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
ж°§еҢ–иҝҳеҺҹеҸҚеә”еңЁе·ҘеҶңдёҡз”ҹдә§гҖҒж—Ҙеёёз”ҹжҙ»дёӯйғҪжңүе№ҝжіӣзҡ„з”ЁйҖ”гҖӮ (1)вҖңжңҚз”Ёз»ҙз”ҹзҙ CпјҢеҸҜд»ҘдҪҝйЈҹзү©дёӯзҡ„ (2)йҮҺиҗҘзҲұеҘҪиҖ…жҗәеёҰж°ўеҢ–й’ҷ( (3) в‘ в‘Ўе·ҘдёҡеҲ¶еӨҮ в‘ўеҶҷеҮәеҲ¶еӨҮ в‘ЈиҮӘжқҘж°ҙдёӯеҠ е…Ҙ13.5g |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
з”өеӯҗе·ҘдёҡдёӯпјҢеёёз”ЁFeCl3жә¶ж¶ІдҪңдёәеҚ°еҲ·з”өи·Ҝй“ңжқҝеҲ»иҡҖж¶ІгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1) FeCl3жә¶ж¶ІеҲ»иҡҖеҚ°еҲ·з”өи·Ҝй“ңжқҝж—¶пјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә______гҖӮ (2)жҹҗжҺўз©¶е°Ҹз»„и®ҫи®ЎеҰӮдёӢзәҝи·ҜеӨ„зҗҶеҲ»иҡҖеәҹж¶ІгҖӮ 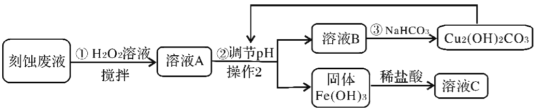 в‘ еңЁеҲ»иҡҖеҚ°еҲ·з”өи·Ҝй“ңжқҝж—¶пјҢжҳҜз”Ёи¶ійҮҸFeCl3пјҢеҲҷеҲ»иҡҖеәҹж¶Ідёӯеҗ«жңүзҡ„йҮ‘еұһйҳізҰ»еӯҗжңү______гҖӮ в‘ЎжӯҘйӘӨв‘ дёӯеҠ е…ҘH2O2жә¶ж¶Ізҡ„зӣ®зҡ„жҳҜ______гҖӮ в‘ўж“ҚдҪң2зҡ„еҗҚз§°дёә______гҖӮ в‘ЈжӯҘйӘӨв‘ўеҠ е…ҘNaHCO3еҸҚеә”ж—¶дјҡдјҙйҡҸдә§з”ҹж— иүІж°”дҪ“пјҢеҲҷеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә______гҖӮ |
|
| 22. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
ж°®еңЁиҮӘ然з•Ңдёӯзҡ„йғЁеҲҶеҫӘзҺҜеҰӮеӣҫгҖӮ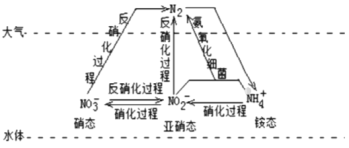 (1)еҰӮеӣҫжүҖзӨәж°®еҫӘзҺҜдёӯпјҢеұһдәҺж°®зҡ„еӣәе®ҡзҡ„жңү______(еЎ«еӯ—жҜҚеәҸеҸ·)гҖӮ a. (2)ж°®иӮҘжҳҜж°ҙдҪ“дёӯй“өжҖҒж°®зҡ„дё»иҰҒжқҘжәҗд№ӢдёҖгҖӮ в‘ ж°Ёж°”жҳҜз”ҹдә§ж°®иӮҘзҡ„дё»иҰҒеҺҹж–ҷпјҢе·ҘдёҡеҗҲжҲҗж°Ёзҡ„еҢ–еӯҰж–№зЁӢејҸдёә______гҖӮ в‘ЎжЈҖйӘҢй“өжҖҒж°®иӮҘдёӯ (3)й“өжҖҒж°®дёҺдәҡзЎқжҖҒж°®еҸҜд»ҘеңЁж°Ёж°§еҢ–з»ҶиҸҢзҡ„дҪңз”ЁдёӢиҪ¬еҢ–дёәж°®ж°”гҖӮиҜҘеҸҚеә”дёӯпјҢеҪ“дә§з”ҹ0.02molж°®ж°”ж—¶пјҢиҪ¬з§»зҡ„з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёә______molгҖӮ (4)еёёжё©дёӢж°Ёж°”иғҪиў«ж°Ҝж°”ж°§еҢ–з”ҹжҲҗ  в… .ж°Ёж°”зҡ„еҲ¶еӨҮгҖӮж¬ІеҲ¶еӨҮе’Ң收йӣҶдёҖ瓶干зҮҘзҡ„ж°Ёж°”еҸҜд»ҘйҖүжӢ©еӣҫдёӯзҡ„иЈ…зҪ®______(еЎ«еӨ§еҶҷеӯ—жҜҚ)гҖӮ в…Ў.ж°Ҝж°”дёҺж°Ёж°”зҡ„еҸҚеә”(е·ІзҹҘпјҡе®һйӘҢеүҚ 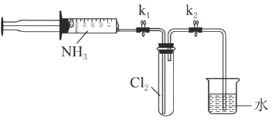 в‘ жү“ејҖ в‘ЎеҶҚжү“ејҖ |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- ж№–еҢ—зңҒе®үйҷҶеёӮ第дёҖдёӯеӯҰ2021еұҠй«ҳдёү8жңҲжңҲиҖғеҢ–еӯҰйўҳеёҰеҸӮиҖғзӯ”жЎҲ
- дә‘еҚ—й«ҳдёүеҢ–еӯҰ2019е№ҙдёҠеҶҢжңҲиҖғжөӢйӘҢзҪ‘дёҠеңЁзәҝеҒҡйўҳ
- 2019еұҠй«ҳдёүеҗҺеҚҠжңҹйҖӮеә”жҖ§иҖғиҜ•зҗҶ科综еҗҲеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲйҮҚеәҶеҚ—ејҖдёӯеӯҰпјү
- й«ҳдёҖдёӢеҚҠе№ҙжңҹжң«ж•ҷеӯҰиҙЁйҮҸжЈҖжөӢеҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙе№ҝдёңзңҒдҪӣеұұеёӮзҰ…еҹҺеҢәпјү
- жұҹиӢҸзңҒжө·е®үй«ҳзә§дёӯеӯҰ2020пҪһ2021е№ҙй«ҳдәҢдёҠжңҹйҳ¶ж®өжЈҖжөӢеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- ж№–е·һдёӯеӯҰй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·ж‘ёеә•иҖғиҜ•йўҳ
- дә‘еӨ©еҢ–дёӯеӯҰеёҰзӯ”жЎҲдёҺи§Јжһҗ
- 驻马еә—еёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•жЁЎжӢҹиҖғиҜ•з»ғд№
жңҖиҝ‘жӣҙж–°







