湖南2019年高三化学下期高考模拟带参考答案与解析
| 1. | 详细信息 |
|
中华传统文化蕴含着很多科学知识。下列说法错误的是 A. “司南之档(勺),投之于地,其柢(柄)指南”。司南中“构”所用材质为Fe2O3 B. “水声冰下咽,沙路雪中平”未涉及化学变化 C. “红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指乙烯 D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴 |
|
| 2. | 详细信息 |
|
NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA C. 生成1mol还原产物时转移电子数为8NA D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA |
|
| 3. | 详细信息 |
下列有关实验的叙述完全正确的是 A. A B. B C. C D. D |
|
| 4. | 详细信息 |
2018年7月12日,我国科学家姜雪峰教授被评为”全球青年化学家元素周期表硫元素代言人”,其是目前为止第一位人选的中国学者。下列说法或推测正确的是 A. 单质S不溶于水,微溶于酒精,易溶于二硫化碳 B. 含氧酸的酸性:Cl>S>P C. 沸点:H2O<H2S<PH3 D. 由H和S形成共价键的过程: |
|
| 5. | 详细信息 |
扁桃酸(Z)是重要的医药合成的中间体,工业上合成它的路线之一如下所示(不考虑立体异构) 下列有关说法错误的是 A. 若反应1发生的是加成反应,则Q是HCN B. X、Y两种分子中共平面的碳原子数目一定相等 C. 可用银氨溶液检验Z中是否含有X D. Z苯环上的二硝基取代产物最多有6种 |
|
| 6. | 详细信息 |
科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如左下图所示,用Cu—Si合金作硅源,在950℃下利用三层液熔盐进行电解精炼,并利用某CH4燃料电池(如下图所示)作为电源。下列有关说法不正确的是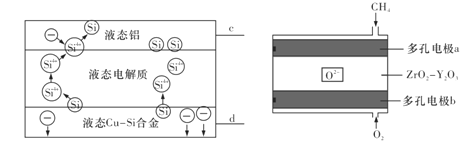 A. 电极c与b相连,d与a相连 B. 左侧电解槽中;Si优先于Cu被氧化 C. a极的电极反应为CH4-8e—+4O2— ===CO2+2H2O D. 相同时间下,通入CH4、O2的体积不同,会影响硅的提纯速率 |
|
| 7. | 详细信息 |
25℃时,向0.1mol/LNaA溶液中滴滴加盐酸,遇得混合溶液的pH与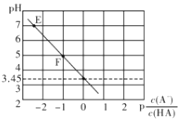 A. E点溶液中c(Na+)=c(A—) B. Ka(HA)的数量级为10—3 C. 滴加过程中 D. F点溶液中c(Na+)>c(HA)>c(A—)>c(OH—) |
|
| 8. | 详细信息 |
|
氯化钠(NaCN)是一种基本化工原料,同时也是一种毒物质。一旦泄漏需要及时处理,一般可以通过喷酒双氧水或过硫酸钠(Na2S2)溶液来处理,以减少对环境的污染。 I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是___________________________________。 II.工业制备过硫酸钠的反应原理如下所示 主反应:(NH4)2S2O8+2NaOH 副反应:2NH3+3Na2S2O8+6NaOH 某化学小组利用上述原理在实验室制备过硫酸,并用过硫酸钠溶液处理含氰化钠的废水。 实验一:实验室通过如下图所示装置制备Na2S2O8。  (2)装置中盛放(NH4)2S2O8溶液的仪器的名称是____________。 (3)装置a中反应产生的气体需要持续通入装置c的原因是____________________。 (4)上述装置中还需补充的实验仪器或装置有______________(填字母代号)。 A.温度计 B水浴加热装置 C.洗气瓶 D.环形玻璃搅拌棒 实验二:测定用过硫酸钠溶液处理后的废水中氯化钠的含量。 已知;①废水中氯化钠的最高排放标准为0.50mg/L。 ②Ag++2CN—===[Ag(CN)2]—,Ag++I—==AgI↓,AgI呈黄色,CN—优先与Ag+发生反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0 (5)滴定终点的现象是___________________________________。 (6)处理后的废水中氰化钠的浓度为____________________mg/L. Ⅲ.(7)常温下,含硫微粒的主要存在形式受pH的影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4—,则阳极主要的反应式为_________________________。 |
|
| 9. | 详细信息 |
锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示: 请回答下列问題: (1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。 (2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。 (3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。  (4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。 (5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。 |
|
| 10. | 详细信息 |
中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成 (1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。 (2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)。 (3)在400℃时,向初始体积为1L的恒压密闭反应器中充入1 molCH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为20.0%。则: ①在该温度下,其平衡常数K=________。 ②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率将_______(填“増大”“减小”“不变”或“无法确定”),理由是__________________________________。 ③若反应器的体积固定,不同压强下可得变化如下图所示,则压强的关系是____________。  ④实际制备C2H4时,通常存在副反应2CH4(g)  I.在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。 II.若在400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,其余为CH4和H2,则体系中CH4的体积分数是____________。 |
|
| 11. | 详细信息 |
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是_______(填字母代号)。 (2)P4S3可用于制造火柴,其分子结构如图所示。  ①P4S3分子中硫原子的杂化轨道类型为_______________。 ②每个P4S3分子中含有的孤电子对的数目为__________________。 (3)科学家合成了一种阳离子“N5n+,其结构是对称的,5个N排成"V"形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”的化学式为”N8”的离子晶体,其电子式为_________________。分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满是8电子稳定结构,其结构式为_____。 (4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为_________________。  (5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径 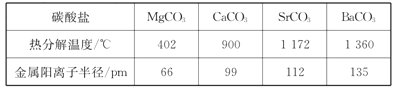 随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是_______________。 (6)石墨的晶体结构和晶胞结构如下图所示。已知石墨的密度为pg・cm3,C—C键的键长为 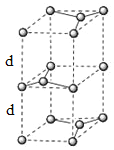 |
|
| 12. | 详细信息 |
蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I)。合成化合物I的路线如下图所示: 已知:①  ②RCHO+HOOCCH2COOH 请回答下列问题 (1)化合物A的名称是_____________;化合物I中官能团的名称是___________。 (2)G→H的反应类型是____________;D的结构简式是___________________。 (3)写出化合物C与新制Cu(OH)2悬浊液反应的化学方程式_______________________。 (4)化合物W与E互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上只有3个取代基,则W可能的结构有__________________(不考虑顺反异构)种,其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为21:2:1:1:1:1,写出符合要求的W的结构简式:________________________________________________________。 (5)参照上述合成路线,设计由CH3CH—CH2和HOOCCH2COOH为原料制备CH2CH2CH= CHCOOH的合成路线(无机试剂及吡啶任选)。_________________________________。 |
|
最近更新



