2017-2018年高一上学期第二次阶段性检测化学考试(湖南师范大学附属中学)
| 1. | 详细信息 |
|
下列叙述正确的是 A. 1molN2的质量为28g/mol B. 标准状况下,1mol任何物质的体积均为22.4 L C. Cl2的摩尔质量为71g D. 3.01×1023个SO2 分子的质量为32 g |
|
| 2. | 详细信息 |
|
下列物质为纯净物的是 A. 泥 B. 青铜 C. 浓硫酸 D. 液氯 |
|
| 3. | 详细信息 |
|
下列与颜色有关的描述中不正确的是 A. 铜在氯气中燃烧产生棕黄色烟 B. FeCl3溶液中加入KSCN溶液产生血红色沉淀 C. 将Cl2通人石蕊溶液,石蕊溶液先变红后褪色 D. 氢气在氯气中燃烧,产生苍白色火焰 |
|
| 4. | 详细信息 |
|
下列反应的离子方程式正确的是 A. 过量CO2 通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2O B. 用小苏打治疗胃酸过多:HCO3- +H+==CO2 ↑+H2O C. Cl2通入水中:Cl2+H2O=Cl-+2H+ +ClO- D. 用FeCl3 溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
|
| 5. | 详细信息 |
|
要除去氯化亚铁溶液中少量的氯化铁,可行的办法是 A. 滴入KSCN溶液 B. 通入氯气 C. 滴入NaOH 溶液 D. 加入铁粉 |
|
| 6. | 详细信息 |
|
二氧化硫能使溴水褪色,说明二氧化硫具有 A. 还原性 B. 氧化性 C. 漂白性 D. 酸性 |
|
| 7. | 详细信息 |
|
某些粒子在化学反应中既能体现氧化性又能体现还原性,下列不属于此类粒子的是 A. Fe2+ B. H2O2 C. Al D. N2 |
|
| 8. | 详细信息 |
|
下列物质可由对应元素的单质在一定条件下直接化合而成的是 A. FeCl2 B. CuS C. SiO2 D. NO2 |
|
| 9. | 详细信息 |
|
下列试剂能够区别SO2 和CO2 气体的是 ①BaCl2溶液②酸性KMnO4 溶液③氯水④品红溶液 ⑤澄清石灰水⑥Na2S溶液 A. ②③④⑤⑥ B. ①②③④⑥ C. ②③④⑥ D. 全部 |
|
| 10. | 详细信息 |
按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是 A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色 B. 若A为醋酸,B为贝壳,C中盛Na2SiO3 溶液,则C中溶液变浑浊 C. 若A为浓氨水,B为生石灰,两者混合后产生NH3,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀溶解 D. 仪器D可以起到防止溶液倒吸的作用 |
|
| 11. | 详细信息 | ||||||||||||||||||||
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
|
|||||||||||||||||||||
| 12. | 详细信息 |
|
在溶液中加入适量Na2O2 后仍能大量共存的离子组是 A. MnO4-、Ba2+、Cl-、NO3- B. Na+、Cl-、CO32-、SO32- C. Ca2+、Mg2+、NO3-、HCO3- D. K+、AlO2-、C1-、SO42- |
|
| 13. | 详细信息 |
|
一定条件下,一种反应物过量,另一种反应物可以完全反应的是 A. 过量的氧气与二氧化硫 B. 过量的氢氧化钠与二氧化硅 C. 过量的二氧化锰与浓盐酸 D. 过量的铜与浓硫酸 |
|
| 14. | 详细信息 |
|
标准状况下,将NO和O2 等体积混合置于试管中,并将试管倒立于盛水的水槽中,发现水槽中的水被吸入试管,反应完成后迅速将试管用橡胶塞塞好,此时,试管中溶液的物质的量浓度为 A. 0.045 mol/L B. 0.0255 mol/L C. 0.0875mol/L D. 无法确定 |
|
| 15. | 详细信息 |
|
某集气瓶内装的混合气体是红棕色,加入足量蒸馏水,盖上玻璃片振荡得橙黄色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色,该混合气体可能是 A. N2、O2、Br2 B. NO2、.NO、N2 C. NO2、NO、O2 D. N2、NO2、Br2 |
|
| 16. | 详细信息 |
|
有下列物质①过氧化钠、②氧化铝、③硅、④二氧化硅。 请根据它们的用途填空:(填序号) (1)可用来制计算机芯片的是_________。 (2)可用于呼吸面具中作为氧气来源的是_________。 (3)能作光导纤维的是_________。 (4)能作耐火材料的是_________。 |
|
| 17. | 详细信息 |
|
用化学方程式解释下列问题: (1)实验室不用石英坩埚熔化NaOH 固体: _________。 (2)漂白粉露置于空气中较长时间后失效: _________。 (3)Fe(OH)2暴露在空气中最后变成红褐色固体: _________。 (4)等物质的量的SO2 与Cl2同时通入水中,溶液无漂白性:_________。 |
|
| 18. | 详细信息 |
A、B、C、D是中学化学中常见的物质,已知C 为红棕色气体,它们之间的相互转化关系如下(部分反应条件及产物已略去)。 (1)若A为单质,则A的化学式为_________,试写出C→D反应的化学方程式:_________。 (2)A亦可为NH3,它与O2 在高温、催化剂的作用下反应生成B,此化学方程式为_________。 |
|
| 19. | 详细信息 |
物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图,回答下列问题: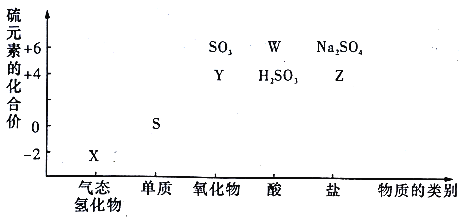 (1)检验Y所用的试剂是_________。 (2)W的稀溶液与铁反应的离子方程式为_________。 (3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_________(填标号)。 a.Na2S+S b.Na2SO3+S c.Na2SO3 +Na2SO4 d.SO2+Na2SO4 (4)将X与Y 的溶液混合,现象为_________,该反应的氧化剂与还原剂的物质的量之比为_________。 |
|
| 20. | 详细信息 |
某化学小组的同学设计了如下实验装置制备SnCl4。 已知:①金属锡熔点为231℃,化学活泼性与铁相似; ②纯净而干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点为114℃; ③SnCl4易与水反应。 请根据上图装置回答: (1)?置I中发生反应的离子方程式是______________。 (2)试管II中的试剂是________,试管III中的试剂是____________。 (3)装置V的作用是____________。 (4)?置Ⅵ 最好选用下列装置中的____(填标号)。 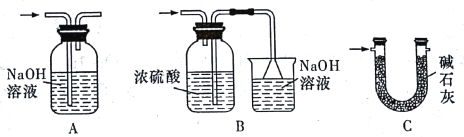 (5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有_________。 |
|
最近更新



