武威市免费检测试卷
| 1. 选择题 | 详细信息 |
|
下列分别是利用不同能源发电的实例,其中不属于新能源开发利用的是( ) A.  风力发电 B. 风力发电 B.  太阳能发电 太阳能发电C.  火力发电 D. 火力发电 D.  潮汐能发电 潮汐能发电 |
|
| 2. 选择题 | 详细信息 |
|
下列变化过程,属于放热反应的是 ①金属钠与水 ②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌 ③H2在Cl2中燃烧 ④液态水变成水蒸气 ⑤酸碱中和 ⑥碳酸钙热分解 A. ①②⑤ B. ①③⑤ C. ③④⑤ D. ②④⑥ |
|
| 3. 选择题 | 详细信息 |
|
在1L密闭容器中加入1molN2和3molH2,一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g),1min后测得生成0.06molNH3,该时间段内以氨气表示的平均反应速率为( ) A.0.06 mol/(L·min) B.0.04 mol/(L·min) C.0.12 mol/(L·min) D.0.24 mol/(L·min) |
|
| 4. 选择题 | 详细信息 |
|
下列说法中不正确的是 A.体系有序性越高,熵值就越低 B.自发过程将导致体系的熵增大 C.吸热反应不可以自发进行 D.同种物质气态时熵值最大 |
|
| 5. 选择题 | 详细信息 |
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )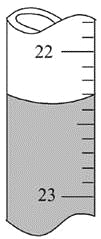 A. 22.30 mL B. 22.35 mL C. 23.65 mL D. 23.70 mL |
|
| 6. 选择题 | 详细信息 |
|
下列热化学方程式中,正确的是( ) A.甲烷燃烧热为890.3 kJ•mol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJ•mol-1 B.稀硫酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJ•mol-1 C.H2燃烧热为285.8kJ•mol-1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ•mol-1 D.500℃、30 MPa下,将1 mol N2和3 mol H2置于密闭的容器中充分反应生成NH3(g),放热38.6 kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| 7. 选择题 | 详细信息 |
|
下列各组物质的燃烧热相等的是 ( ) A.碳和一氧化碳 B.1mol碳和3mol碳 C.3mol乙炔(C2H2)和1mol苯(C6H6) D.天然气和酒精 |
|
| 8. 选择题 | 详细信息 |
|
下列实验操作不当或实验结论错误的是 ( ) A.用过氧化氢溶液制取氧气时,加少量MnO2以加快反应速率 B.用标准HCl溶液滴定NaOH溶液来测定其浓度,选择酚酞为指示剂 C.用铂丝蘸取某碱金属的化合物溶液灼烧火焰呈黄色,证明该化合物是钠盐 D.给试管里的液体加热,液体体积一般不超过试管容积的三分之一 |
|
| 9. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合,正确的是 ( )
|
||||||||||||||||||||||||||
| 10. 选择题 | 详细信息 |
|
下列事实不能用勒夏特列原理来解释的是 A. 将混合气中的氨气液化分离,有利于合成氨的反应 B. 用过量氮气与氢气反应可以提高氢气的转化率 C. 密闭容器中发生反应H2(g)+I2(g) D. 加压有利于SO2与O2反应生成SO3 |
|
| 11. 选择题 | 详细信息 |
|
下列事实不能证明HNO2是弱电解质的是 ( ) A.滴入酚酞试液,NaNO2溶液显红色 B.用HNO2溶液做导电实验,灯泡很暗 C.HNO2溶液中的微粒中有:HNO2、H+、NO D.0.10 mol/L HNO2溶液的pH=2 |
|
| 12. 选择题 | 详细信息 |
|
设 NA 为阿伏加德罗常数的值。下列说法正确的是( ) A.密闭容器中,2 mol SO2 和足量 O2 充分反应,SO3的分子数为 2 NA B.含 NA个 CO C.11.2 L 甲烷和乙烯的混合物中含氢原子数目为 2 NA D.44 g CO2 气体中含氧原子数目为 2 NA |
|
| 13. 选择题 | 详细信息 |
|
常温下,0.1 mol·L-1的下列溶液中c(NH4+)最大的是( ) A. NH4Al(SO4)2 B. NH4Cl C. NH3.H2O D. CH3COONH4 |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
下列实验误差分析合理的是 ( )
|
||||||||||||||||
| 15. 选择题 | 详细信息 |
|
已知25 ℃时,Ksp(BaSO4)=1.1×10-10。则在0.35 mol·L-1的Na2SO4溶液中,Ba2+的最大浓度是( ) A.3.1×10-10 mol·L-1 B.8.4×10-10 mol·L-1 C.4.2×10-10 mol·L-1 D.5.8×10-10 mol·L-1 |
|
| 16. 选择题 | 详细信息 |
|
能正确解释下列反应原理,并且书写的离子方程式正确的是( ) A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O C.电解MgCl2饱和溶液制取Mg:MgCl2 D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42- |
|
| 17. 选择题 | 详细信息 |
|
已知反应 2NH3⇌N2+3H2,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应N2 + 3H2⇌2NH3的平衡常数为( ) A.4 B.2 C.1 D.0.5 |
|
| 18. 选择题 | 详细信息 |
|
25℃,在0.01mol/LHCl溶液中,由水电离出的c(H+)是( ) A.5×10-13mol/L B.0.02mol/L C.1×10-7mol/L D.1×10-12mol/L |
|
| 19. 选择题 | 详细信息 |
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)⇌pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( ) A.由图a可知,T1>T2,该反应的正反应为放热反应 B.由图b可知,该反应m+n<p C.图c是绝热条件下速率和时间的图像,由此说明该反应吸热 D.图d中,若m+n=p,则曲线a一定增大了压强 |
|
| 20. 填空题 | 详细信息 |
|
已知下列热化学方程式: ①2H2(g) +O2(g) = 2H2O(l) △H = -571.6 kJ/mol ②C(s) + O2(g) = CO2(g) △H = -393.5 kJ/mol ③C(s) + H2O(g) = CO(g) + H2(g) △H = +131.5 kJ/mol 请回答: (1)上述反应中属于放热反应的是_______(填序号),固体碳的燃烧热为_______。 (2)1molH2完全燃烧生成液态水,放出的热量为_______。 (3)依据事实,写出下列反应的热化学方程式。 ①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为_______。 ②已知HCl稀溶液与NaOH稀溶液反应生成1mol H2O时,放出57.3kJ热量,用离子方程式表示该反应的热化学方程为_______。 |
|
| 21. 填空题 | 详细信息 |
|
完成下面的题。 (1)CH3COOH溶于水的电离方程式为_______;向CH3COOH溶液中加入醋酸钠固体时,电离平衡向_______移动(填“左”或者“右”);c(H+)_______,c(CH3COO-)_______。(填“增大”、“减小”“不变”,上同) (2)0.1 mol/LHCl溶液的pH为_______。 (3)某温度下,水的离子积常数KW=1×10-12,则此温度_______25℃,原因是_______。 |
|
| 22. 计算题 | 详细信息 |
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。 (1)若CO2的转化率为40%时,反应放出的热量为_______kJ; (2)从反应开始到平衡,氢气的平均反应速率v(H2)=_______mol/(L·min); (3)判断该可逆反应达到化学平衡状态的标志是_______(填字母)。 a.v生成(CH3OH)=v消耗(CO2) b.混合气体的密度不再改变 c.混合气体的平均相对分子质量不再改变 d.CO2、H2、CH3OH、H2O的浓度均不再变化 (4)该反应的平衡常数表达式为K=_______。 |
|
| 23. 填空题 | 详细信息 |
|
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得知,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO ①称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。 ②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4 ③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;请回答: (1)将草酸晶体配制成溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、_______、_______。 (2)滴定时,将KMnO4标准液装在图中的_______(填“甲”或“乙”)滴定管中。  (3)下列滴定操作会使测得的x值偏大的是_______。 A.滴定终点时俯视滴定管刻度 B.滴定终点时仰视滴定管刻度 C.滴定时所用的KMnO4溶液因久置而导致浓度变小 D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失 |
|
最近更新



