成都市免费试卷
| 1. 选择题 | 详细信息 |
|
生活是化学的源泉。下列叙述错误的是( ) A.75%浓度的酒精、含氯消毒剂均可以有效灭活新型冠状病毒 B.许多食品包装盒里用小袋包装的铁粉来防止食品氧化变质 C.生产宇航服所用的碳化硅陶瓷和碳纤维材料,是一种新型无机非金属材料 D.可溶性铜盐有毒,故人体内不存在铜元素 |
|
| 2. 选择题 | 详细信息 |
|
在给定条件下,下列选项所示物质间的转化不能一步实现的是 A. C. |
|
| 3. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列有关物质的俗称、分类和用途的说法都正确的是( )
|
||||||||||||||||||||||||||
| 4. 选择题 | 详细信息 |
|
NA是阿伏加德罗常数的值。下列说法正确的是( ) A. 1L 0.1mol·L-1的CH3COOH溶液能电离出H+数目为0.1NA B. 标准状况下,22.4 LSO3含氧原子数为3NA C. 50 mL 12 mol·L-1浓盐酸与足量二氧化锰共热反应,生成Cl2分子的数目为0.15NA D. 7.8gNa2O2晶体中阴阳离子总数为0.3NA |
|
| 5. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A.用湿润的pH试纸测定 B.常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸不与铁、铝反应 C.侯德榜是我国近代化学工业的奠基人之一,侯氏制碱法得到的“碱”是碳酸钠 D.节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽的色彩,所以焰色试验是化学变化 |
|
| 6. 选择题 | 详细信息 |
下列关于实验基本操作的叙述错误的是( ) A.用容量瓶配制溶液,容量瓶洗净后无需烘干即可使用 B.用分液漏斗分离汽油和水,分别用两个烧杯在下口接水和汽油 C.蒸发溶液时,不需垫石棉网可直接对蒸发皿加热 D.蒸馏时,应选用如图所示的仪器对蒸气进行冷凝 |
|
| 7. 选择题 | 详细信息 |
|
已知反应2FeSO4 A.每生成16gSO3,该反应转移的电子数为0.8NA B.2molSO2和1molO2充分反应后,气体分子数为2NA C.若将生成的气体通入氯化钡溶液中,得到的沉淀物是BaSO4 D.2mol/LFeSO4溶液中,SO |
|
| 8. 选择题 | 详细信息 | ||||||||||||||||||||||||
某同学血常规体检报告的部分指标如表:
其中的“葡萄糖”是指血液中的葡萄糖(分子式C6H12O6),简称血糖。已知1mmol=1×10-3 mol,下列说法正确的是( ) |
|||||||||||||||||||||||||
| 9. 选择题 | 详细信息 |
|
下列关于金属及其化合物的说法正确的是( ) A.已知CCl4不可燃且不与Na反应,故少量的Na可保存在CCl4液体中 B.向紫色石蕊试液中加入较多Na2O2粉末,溶液变为蓝色并有气泡产生 C.还原铁粉与水蒸气在高温下反应生成有磁性的氧化亚铁 D.胃酸过多的病人,可以服用适量含有氢氧化铝的胃药 |
|
| 10. 选择题 | 详细信息 |
|
下列大小关系正确的是( ) A.稳定性:NaClO>HClO B.熔点:镁铝合金>金属铝 C.溶解度:NaHCO3>Na2CO3 D.同温同压下的密度:NO>NO2 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验操作、现象、解释或结论都正确的是( )
|
|||||||||||||||||||||
| 12. 选择题 | 详细信息 |
|
下列各组离子在溶液中能大量共存,加入足量盐酸既有沉淀析出又有气体放出的是( ) A.Na+、Ag+、CO C.Na+、SO |
|
| 13. 选择题 | 详细信息 |
|
下列关于除杂试剂的选择正确的是(括号中的物质为杂质)( ) A.CO2(SO2):饱和Na2CO3溶液 B.Cl2(HCl):饱和食盐水 C.NaHCO3(Na2CO3):澄清石灰水 D.NO2(NO):水 |
|
| 14. 选择题 | 详细信息 |
把b中三个碎纸片补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )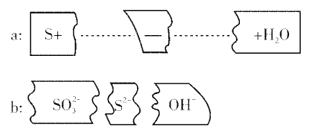 A.该反应不是氧化还原反应 B.S2-是该反应的还原产物 C.b中反应物微粒为SO D.反应中氧化剂与还原剂的质量比为1:1 |
|
| 15. 选择题 | 详细信息 |
常温下,c(H+)=0.1mol/L的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO 已知氧化性Fe3+>I2。根据实验结果,判断下列说法正确的是( ) A.Fe3+与Fe2+至少有一种 B.一定不存在CO C.一定存在Fe2+、I-、Cl- D.该溶液中一定存在Fe2+、I-,可能含Cl- |
|
| 16. 选择题 | 详细信息 |
|
在一定量铁的氧化物中,加入 45mL 4 mol/L 硫酸溶液恰好完全反应,所得溶液中 Fe2+能恰好被标准状况下 672 mL 氯气氧化。则该固体中氧原子和铁原子的个数之比为( ) A. 9:7 B. 3:2 C. 6:5 D. 4:3 |
|
| 17. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A.浓硝酸中加入过量铁粉并加热:Fe+3 B.Ca(HCO3)2溶液与过量NaOH溶液反应 C.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O D.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+ |
|
| 18. 选择题 | 详细信息 |
|
在离子浓度都为0.1mol/L的下列溶液中,加入(通入)某物质后,发生反应的先后顺序排列正确的是( ) A.在含 B.在含Fe3+、Br2的水溶液中滴加KI溶液:Fe3+、Br2 C.在含KI、NaBr的溶液中通入Cl2:KI、NaBr D.在含Ag+、Cu2+的溶液中加入Zn:Cu2+、Ag+ |
|
| 19. 选择题 | 详细信息 |
|
把物质的量浓度比为1:2的硫酸和硝酸等体积混合(忽略混合前后溶液体积的变化),已知10mL该混酸溶液能被20mL3mol/L的NaOH溶液恰好中和,下列有关说法正确的是( ) A.该混酸溶液能与Cu反应放出H2 B.硫酸和硝酸的混合溶液叫王水 C.混合溶液中c(HNO3)=3mol/L D.另取10mL混酸溶液与足量BaCl2反应,所得沉淀质量为0.699g |
|
| 20. 选择题 | 详细信息 |
将一定质量由镁和铝组成的合金投入200 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加6 mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如下图所示: 下列说法不正确的是 A. 镁铝合金中,Mg与Al的物质的量之比为 2∶1 B. 所用盐酸的物质的量浓度为4 mol/L C. 图像中的x=20 D. 图像中,Ox 段的离子方程式为:H++OH-= H2O;y~150 段的离子方程式为:Al(OH)3+OH-=AlO2-+ 2H2O |
|
| 21. 填空题 | 详细信息 |
|
化学与生产、生活、环境息息相关。从化学视角回答下列问题: (1)钠在空气中的燃烧产物A可用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为_______(写一种即可)。 (2)家庭的厨卫管道内常因留有油脂、毛发、菜渣、纸棉纤维等而造成堵塞,此时可用固体管道疏通剂进行疏通。管道疏通剂主要成分为铝和氢氧化钠,疏通管道时发生反应的离子方程式是_______,必须注意的安全警示是_______。 (3)亚硝酸钠被称为工业盐,有毒,但在肉类制品加工中又可以加入极少量用作发色剂、防微生物剂、防腐剂,在漂白、电镀和金属处理等方面有应用。已知NaNO2能发生反应:_______NaNO2+_______HI→_______NO↑+_______I2+_______NaI+_______H2O ①配平上述化学方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目_______。 ②该反应中HI表现的性质是_______;氧化剂与还原剂的物质的量之比为_______;反应中转移0.3 mol电子时生成标准状况下的NO_______L。 ③误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒,维生素C在解毒过程中作_______剂。 |
|
| 22. 实验题 | 详细信息 |
二氧化氯(ClO2)是自来水常用的消毒剂。已知:ClO2常温下为黄绿色气体,易溶于水而不与水反应,11℃时液化成红棕色液体,在空气中的体积分数超过10%时有爆炸性,ClO2溶于碱溶液生成亚氯酸盐和氯酸盐。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。制取的装置如图所示(夹持装置已略去)。 (1)下列有关ClO2的说法正确的是___________(填序号); A.ClO2与氯气从颜色上难以区分 B.可以用向上排空气法收集,但不能用排水法收集 C.属于酸性氧化物 D.ClO2用于杀菌、消毒是因为它具有强氧化性 (2)冰水浴的作用是___________。 (3)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应(氧化剂和还原剂为同一种物质的反应),每生成1molClO2消耗NaClO2的量为___________mol;产生“气泡”的化学方程式为___________。 (4)①ClO2在杀菌消毒过程中会产生副产物次氯酸钠,实验室可用H2O2与次氯酸钠反应将其转化为Cl-而除去,反应的化学方程式___________。 ②Na2O2、CaO2以及BaO2都可与酸反应生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸反应,过滤后即可制得较纯净的H2O2溶液,则最好选择的过氧化物是___________。 |
|
| 23. | 详细信息 |
铝土矿的主要成分是Al2O3,含Fe2O3、SiO2、MgO等杂质,从铝土矿中提取氧化铝的两种工艺流程如图所示: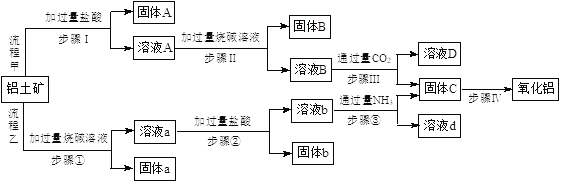 回答下列问题: (1)固体a的主要成分为_______(填化学式,下同),溶液A和溶液b中共同存在的溶质为_______。 (2)能否将步骤Ⅱ中的烧碱溶液替换为氨水?请回答并简述理由_______。 (3)步骤Ⅲ中发生反应的离子方程式为_______、_______;步骤②中Al元素发生反应的离子方程式为_______。 (4)除步骤Ⅳ外,其余每个步骤都要采取的实验操作为_______。Al2O3、SiO2、MgO都可用于制造耐火坩埚,实验室熔融烧碱时可以选用_______(填标号)。 A.铁坩埚 B.氧化铝坩埚 C.石英坩埚 D.氧化镁坩埚 |
|
| 24. 实验题 | 详细信息 | |||||||||
某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。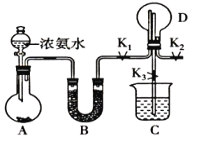 (1).装置A中烧瓶内试剂可选用___________(填序号) a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体 (2).氨气是一种极易溶于水的有害气体,为了防止多余的氨气扩散到空气中,则需要在K2的导管末端连接下表装置中的___________(填序号)装置,如何检验收集的一瓶气体是氨气的实验操作___________,当装置D中集满氨气后,关闭K1、K2,打开K3引发喷泉的实验操作是___________。
(3).若探究氨气的还原性,需要打开K1、K3,K2处导管连接制取纯净、干燥氯气的装置。 |
||||||||||
| 25. 实验题 | 详细信息 | ||||||
为探究Fe(NO3)2晶体的热分解产物。某化学兴趣小组按图进行了如下实验,回答下列问题∶ ①实验时观察到A处试管中有红棕色气体生成,说明硝酸亚铁晶体分解产物含有___________,B中无水硫酸铜变蓝,说明分解产物中含有___________ ②检验热分解后的固体为氧化铁的方案为
由以上实验结果写出Fe(NO3)2·xH2O分解的化学方程式___________ |
|||||||