北京市高三化学下册月考试卷模拟考试练习
| 1. 选择题 | 详细信息 | ||||||||||||
石油化学工业是国民经济重要支柱之一,下列有关石油化工的叙述错误的是( )
|
|||||||||||||
| 2. 选择题 | 详细信息 |
|
下列有关物质的表达式不正确的是( ) A.1, 3-丁二烯的分子式:C4H6 B.乙炔的电子式: C.甲醛的结构式: |
|
| 3. 选择题 | 详细信息 |
|
合理饮食、营养均衡有利于身体健康,下列叙述错误的是( ) A.大米、小麦中含有淀粉,消化吸收后可为生命活动提供能量 B.肉、蛋、奶中的蛋白质,需水解成氨基酸后才能吸收 C.久置的油脂变味不能食用,是由于油脂发生了水解反应 D.水果、蔬菜是维生素、无机盐和膳食纤维的重要来源 |
|
| 4. 选择题 | 详细信息 |
I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是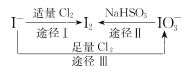 A.用淀粉-KI试纸和食醋可检验食盐是否加碘 B.由图可知氧化性的强弱顺序为Cl2>IO3->I2 C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2 D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+ |
|
| 5. 选择题 | 详细信息 |
|
下列反应的离子方程式不正确的是( ) A.NaOH溶液腐蚀玻璃瓶塞:SiO2 +2OH-=SiO32- + 2H2O B.实验室制Cl2:MnO2+4HCl(浓) C.向Mg(OH) 2悬浊液中加入FeCl3溶液:2Fe3++3Mg(OH)2 ==2 Fe(OH)3+3Mg2+ D.向Ba(OH)2溶液中加入少量NaHSO3溶液: HSO3-+Ba2++OH-=BaSO3↓+H2O |
|
| 6. 选择题 | 详细信息 |
|
下列实验现象与盐类水解无关的是( ) A.等体积、等物质的量浓度的盐酸与氨水混合溶液显弱酸性 B.1 mol/L的醋酸加水稀释,溶液的pH增大,导电能力减弱 C.氮肥NH4HCO3与钾肥K2CO3混施可能会降低肥效 D.向20 mL沸水中滴加适量饱和FeCl3溶液,形成红褐色胶体 |
|
| 7. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验操作、现象和结论均正确的是( )
|
|||||||||||||||||||||
| 8. 选择题 | 详细信息 |
|
常温下,100 mL 1.0 mol/L Na2C2O4 溶液中加入足量pH=1的稀硫酸,再加入20 mL KMnO4溶液恰好完全反应。下列说法正确的是( ) A.Na2C2O4溶液中C2O42-数目为0.1N A B.稀硫酸中水电离的c(H+)=0.1 mol/L C.KMnO4溶液浓度为0.1 mol/L D.反应过程中转移电子数为0.2NA |
|
| 9. 选择题 | 详细信息 |
可降解有机高分子C合成原理如下: 下列说法不正确的是( ) A.A完全水解只能得到两种氨基酸 B.单体B结构简式是 C.有机物C可发生加成反应和水解反应 D.该反应属于缩聚反应 |
|
| 10. 选择题 | 详细信息 |
常温下,用0.1 mol·L1KOH溶液滴定10 mL 0.1 mol·L1 HA溶液的滴定曲线如图所示。下列说法不正确的是( )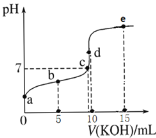 A.a≈3,说明HA属于弱酸 B.水的电离程度:d点>c点 C.e点溶液中:c(K+)=2c(A-)+2c(HA) D.b点溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-) |
|
| 11. 选择题 | 详细信息 |
BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )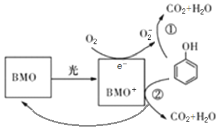 A.O2-不如O2结构稳定 B.①和②中被降解的苯酚的物质的量之比为1:1 C.降解产物的分子中只含有极性共价键 D.该过程的总反应: |
|
| 12. 选择题 | 详细信息 |
利用太阳能电解水制H2是解决能源危机的重要方向。采用固体氧化还原调节剂作为离子交换体系,实现H2、O2分离。下列分析正确的是( )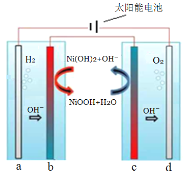 A.左侧电解池应选用酸性溶液,a极反应式为:2H+ + 2e-=H2↑ B.b极反应式:NiOOH + H2O + e-=Ni(OH)2 + OH- C.c为阳极,发生氧化反应 D.电解一段时间后,可将b、c对调,循环利用物质 |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||||||||||
在2L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
|
|||||||||||||||||||||||||||||
| 14. 选择题 | 详细信息 | ||||||||||||
高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下: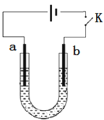
|
|||||||||||||
| 15. 综合题 | 详细信息 |
|
已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题: (1)Lv在周期表中的位置是_________。 (2)下列有关性质的比较,能用元素周期律解释的是_________。 a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4 (3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________。 (4)实验室用如下方法制备H2S并进行性质验证。  ①设计B装置的目的是证明_________,B中实验现象为_______________。 ②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________。 ③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________。 |
|
| 16. 综合题 | 详细信息 |
|
氨氮废水是生活中常见污染物之一,可用电解法加以去除。实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl混合溶液来模拟该过程。 (1)电解处理氨氮废水电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:  ①根据图中数据,处理废水合适的条件是_______________。 ②实验中发现阳极会持续产生细小气泡,气泡上浮过程中又迅速消失。结合图1,用电极反应式和离子方程式解释Cl-去除氨氮的原因_______________。 ③图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是_______________。 (2)氨的定量测定使用下图装置检测废水中的氨氮总量是否合格。  ①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。 ②若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则样品混合液中氨氮(以氨气计)含量为_______________mg·L-1。 |
|
| 17. 推断题 | 详细信息 |
传统中草药金银花对治疗“新冠肺炎”有效,其有效成分“绿原酸”的一种人工合成路线如下: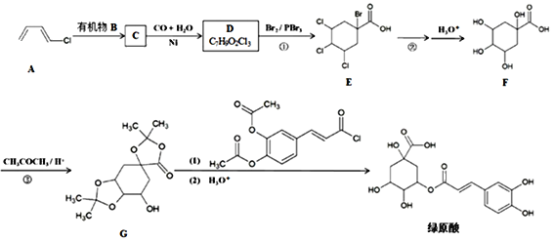 已知:i. ii. 回答下列问题: (1)有机物B的名称是__________。 (2)C→D反应生成的官能团是__________。 (3)反应①的反应类型是__________。 (4)反应②的化学方程式是__________。 (5)反应③的目的是__________。 (6)G→绿原酸反应中,若水解时间过长会降低绿原酸产率,生成副产物F和(写结构简式)_______________。 (7)参照上述合成方法,设计三步反应完成以丙酸为原料制备高吸水性树脂聚丙烯酸钠 (无机试剂任选) ,写出合成路线__________。 |
|
| 18. | 详细信息 |
某锂离子电池正极材料有钴酸锂(LiCoO2)、石墨和铝箔等,该电池充电时负极(阴极)反应为6C+xLi++xe- = LixC6,锂电池充放电过程中发生LiCoO2与Li1-xCoO2之间的转化。现利用以下工艺回收正极材料中的某些金属资源。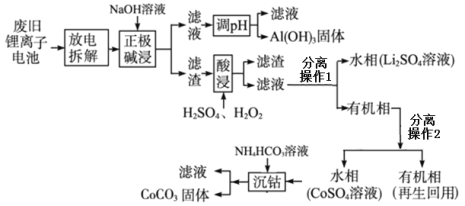 回答下列问题: (1)放电时电池总反应方程式_______________;该工艺首先将废旧电池“放电处理”的目的除安全外还有_______________。 (2)写出“正极碱浸”过程中发生反应的离子方程式_______________。 (3) 分离操作1是_______________;“酸浸”步骤发生的氧化还原反应化学方程式是_______________。 (4)“酸浸”时若用盐酸代替H2SO4和H2O2的混合液,缺点是_______________。 (5)“沉钴”过程中的实验现象有_______________。 |
|
| 19. 实验题 | 详细信息 | |||||||||
|
某学习小组探究SO2与Cu(OH)2悬浊液的反应。 实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl- 、SO42-、SO32-、HSO3-。 已知: i. Cu(NH3)42+(蓝色);Cu+ ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。 实验Ⅱ:  (1)①通过“白色沉淀A”确定一定存在的离子是____________________。 ②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是____________________。 ③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是____________________。 ④生成CuCl的离子方程式是____________________。 (2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。 ①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是____________________。
|
||||||||||







