2019-2020年高二上半期期中考试化学试卷带参考答案和解析(黑龙江省鹤岗市第一中学)
| 1. 选择题 | 详细信息 |
|
下列物质的沸点按由高到低的顺序排列正确的是 ①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3 A.②④①③ B.④②①③ C.④③②① D.②④③① |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 碳碳间以单键结合,碳原子的其他价键全部与氢原子结合的烃一定是饱和链烃 B. 分子组成符合CnH2n+2(n为正整数)的烃一定是烷烃 C. 正戊烷分子中所有的碳原子均在一条直线上 D. 碳氢原子个数比为1∶3的烃有2种 |
|
| 3. 选择题 | 详细信息 |
|
在150℃,由任意比例组成的混合气体1L,在9L过量的氧气中充分燃烧后,恢复到反应前的温度,体积仍为10L,则该混合气体的成分可能是 A. C2H4和C3H4 B. CH4和C2H6 C. CH4和C2H2 D. C2H6和C3H6 |
|
| 4. 选择题 | 详细信息 |
|
下列说法中正确的是 A.相对分子质量相同的物质是同种物质 B.分子式相同的不同有机物一定是同分异构体 C.分子组成相差若干个CH2的两种有机物互为同系物 D.符合通式CnH2n+2的不同烃一定互为同系物 |
|
| 5. 选择题 | 详细信息 |
|
异丁烷的二氯代物的同分异构体共有 A.3种 B.4种 C.5种 D.6种 |
|
| 6. 选择题 | 详细信息 |
|
(CH3CH2)2CHCH3的正确命名是( ) A.2﹣乙基丁烷 B.2﹣甲基戊烷 C.3﹣甲基戊烷 D.3﹣乙基丁烷 |
|
| 7. 选择题 | 详细信息 |
|
下列各组有机物中,其一氯代物的数目不相等的是( ) A.正戊烷 和 正己烷 B.新戊烷 和 2-甲基丙烷 C.2,2,3,3-四甲基丁烷 和 乙烷 D.丙烷 和 2,3-二甲基丁烷 |
|
| 8. 选择题 | 详细信息 |
|
下列物质分类时,按强电解质、弱电解质 、非电解质排列的正确的是( ) A.NaCl、HF、Cu B.NaHSO4、CH3COONH4、CCl4 C.BaSO4、CH3COOH、C2H5OH D.Cu(OH)2 、HCN、CO2 |
|
| 9. 选择题 | 详细信息 |
|
下列事实一定能证明HNO2是弱电解质的是( ) ①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2和NaCl不能发生反应 ④0.1 ⑤NaNO2和 A.①②③ B.①②④ C.①④⑤ D.全部 |
|
| 10. 选择题 | 详细信息 |
|
已知100℃时,水的离子积常数是10-12mol2•L-2。在该温度下,pH=3的盐酸和pH=9的氢氧化钠溶液以体积比11:9混合,混合液的pH为 A. 约3.3 B. 8 C. 6 D. 4 |
|
| 11. 选择题 | 详细信息 |
|
已知室温下,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( ) A.HA电离出的c(H+)与水电离出的c(H+)之比为108 B.升高温度,溶液的pH减小 C.溶液的pH=4 D.HA的电离平衡常数约为l×10-7 |
|
| 12. 选择题 | 详细信息 |
|
常温下,下列各组离子一定能在指定溶液中大量共存的是 A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN- B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32- C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42- =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3- |
|
| 13. 选择题 | 详细信息 |
|
下列有关问题,与盐的水解有关的是 ①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤Al2S3不能通过溶液中的反应制取 A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤ |
|
| 14. 选择题 | 详细信息 |
|
现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( ) A.向①中逐滴加入少量②, B.①、③等体积混合后溶液中存在:NH4+ +H2O C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ ) D.①、③按体积比2:1混合:c(NH4+)>c(NH3•H2O)>c(SO42-)>c(OH-)>c(H+) |
|
| 15. 选择题 | 详细信息 |
|
在一定条件下,Na2CO3溶液存在水解平衡: A.稀释溶液,水解平衡常数增大 B.加入少量NH4Cl固体,平衡朝正反应方向移动 C.升高温度, D.加入NaOH固体,溶液pH减小 |
|
| 16. 选择题 | 详细信息 |
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如图所示。据图判断不正确的是( )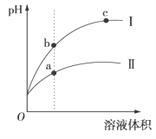 A. I是盐酸,Ⅱ是醋酸 B. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同 C. a、b、c三点KW的数值相同 D. 溶液的导电性a>b>c |
|
| 17. 选择题 | 详细信息 | ||||||||||||
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
|
|||||||||||||
| 18. 选择题 | 详细信息 |
|
浓度均为0.1mol/L的以下几种溶液:①NH4Cl;②NH3·H2O;③NH4HSO4;④(NH4)2SO4;⑤NH4HCO3;⑥(NH4)2CO3;⑦(NH4)2Fe(SO4)2,NH4+浓度由大到小的顺序是 A. ④⑥⑦②③①⑤ B. ②⑤①③⑥④⑦ C. ⑥④⑦①⑤②③ D. ⑦④⑥③①⑤② |
|
| 19. 选择题 | 详细信息 |
在25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是 A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B.根据滴定曲线,可得Ka(HY)≈10-6 C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(Na+)>c(H+) D.HY与HZ混合,达到平衡时:c(H+)=c(Y-)+c(Z-)+c(OH-) |
|
| 20. 选择题 | 详细信息 |
如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是 A. CaCO3(s) B. a、b、c、d四点对应的溶度积Ksp相等 C. 温度不变,蒸发水,可使溶液由a点变到c点 D. 25 ℃时,CaCO3的Ksp=2.8×10-9 |
|
| 21. 填空题 | 详细信息 |
|
在下列各组物质中,找出合适的序号填在对应的空格内: ①白磷和红磷;②NO2和N2O4;③12C和14C;④  (1)互为同位素的是_____________; (2)互为同分异构体的是__________; (3)互为同素异形体的是_________; (4)同一物质的是__________ |
|
| 22. 实验题 | 详细信息 |
把1 mol CH4 和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题: (1)片刻后试管中的现象为: ①试管内气体的颜色变浅,②试管壁上出现_________________________、③试管内__________________、____________________。 (2)在反应结束后,试管内的产物最多的是___________,空间构型呈正四面体的产物为___________。 (3)若(2)中生成的四种有机产物的物质的量相同,则反应消耗的Cl2的物质的量为________mol。 (4)与CH4相邻同系物的结构简式为_______________该同系物与Cl2发生一氯取代反应的化学方程式为__________________________。 |
|
| 23. 综合题 | 详细信息 | ||||||||
|
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。 (1)已知部分弱酸的电离常数如下表:
|
|||||||||
| 24. 综合题 | 详细信息 |
|
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题: (1)写出酸H2A的电离方程式_________________________。 (2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__________________________。(溶液混合时体积变化忽略,下同) (3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。 (4)25℃时,amol/L氨水和0.01mol/L盐酸等体积混合充分反应后,c(NH4+)= c(Cl-)求一水合氨的电离常数K= _____________ |
|
| 25. 实验题 | 详细信息 | ||||||||||||||||||
|
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下: ① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上 ② 固定好滴定管并使滴定管尖嘴充满液体 ④调节液面至“0”或“0”刻度线稍下,并记下读数 ④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液 ⑤用标准液滴定至终点,记下滴定管液面读数。 填空:(1)以上步骤有错误的是(填编号)_________,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”) (2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”) (3)判断滴定终点的现象是:___________________________________; (4)如下图是某次滴定时的滴定管中的液面,其读数为_________mL  (5)根据下列数据:请计算待测盐酸溶液的浓度:_______________________mol·L-1
|
|||||||||||||||||||




