昭通市高一化学上册期末考试刷题训练
| 1. 选择题 | 详细信息 |
|
含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有的Cl﹣为1.8 mol,Na+为2 mol,Mg2+为0.5 mol,则SO42-的物质的量为( ) A. 0.6 mol B. 0.7 mol C. 1.2 mol D. 1.0 mol |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 金属氧化物都是碱性氧化物 B. 盐电离出的阳离子不一定有金属离子 C. 由不同种元素组成的物质一定是化合物 D. 非金属氧化物都是酸性氧化物 |
|
| 3. 选择题 | 详细信息 |
|
“神舟”号载人航天器中,宇航员所在的返回舱都是密封的,宇航员吸入氧气,呼出二氧化碳,如果二氧化碳浓度过大,会使宇航员困乏,呼吸频率加快,严重的会窒息,为使二氧化碳浓度降低而保持舱内氧气的适当比例,可以在返回舱内放入( ) A. 过氧化钠 B. 碳酸钠 C. 氢氧化钠 D. 氧气瓶 |
|
| 4. 选择题 | 详细信息 |
|
在反应SiO2+3C A. 36∶60 B. 60∶36 C. 1∶2 D. 1∶3 |
|
| 5. 选择题 | 详细信息 |
|
下列物质中属于纯净物的是( ) A.氯水 B.液氯 C.次氯酸溶液 D.液态空气 |
|
| 6. 选择题 | 详细信息 |
|
40.5 g某金属氯化物RCl2含有0.6 mol 氯离子,则金属R的摩尔质量为( ) A. 135 g B. 135 g·mol-1 C. 64 g D. 64 g·mol-1 |
|
| 7. 选择题 | 详细信息 |
|
下列有关氮元素的单质及其化合物的说法错误的是 ①氮气与氧气在放电的条件下可直接生成NO2②铵盐都不稳定,受热分解都生成氨气③向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化④实验室加热氯化铵固体,用碱石灰除去氯化氢的方法制备氨气 A. ①③④ B. ①③ C. ①④ D. ①②③④ |
|
| 8. 选择题 | 详细信息 |
|
关于氧化钠和过氧化钠的叙述正确的是( ) A. 氧化钠比过氧化钠稳定 B. 都能与二氧化碳、水反应产生氧气 C. 所含氧元素的化合价都为-2价 D. 阴阳离子的个数比都为1∶2 |
|
| 9. 选择题 | 详细信息 |
|
人类的生产和生活中离不开金属材料。通常所说的“金属材料”,既包括纯金属,也包括各种合金。下列不属于合金的是( ) A. 黄铜 B. 铁锈 C. 生铁 D. 焊锡 |
|
| 10. 选择题 | 详细信息 |
|
下列有关物质的分类正确的是( ) A. 单质:生铁、赤铜、青铜 B. 有机物:甲烷、葡萄糖、乙醇 C. 纯净物:冰水混合物、纯碱、98%浓硫酸 D. 氧化物:双氧水、生石灰、烧碱 |
|
| 11. 选择题 | 详细信息 |
|
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是( ) A. 0.1 mol·L-1的蔗糖溶液 B. 0.1 mol·L-1的CaCl2溶液 C. 0.2 mol·L-1的NaCl溶液 D. 0.1 mol·L-1的盐酸 |
|
| 12. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数,下列说法正确的是( ) A.1 mol氦气中有2NA个氦原子 B.14 g氮气中含6.02×1023个氮原子 C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+ D.18 g水中所含的电子数为10NA |
|
| 13. 选择题 | 详细信息 |
|
某金属与氯气反应生成的化合物中,其质量比为1∶1.9,原子个数比为1∶3,则金属的相对原子质量为 A. 27 B. 56 C. 23 D. 64 |
|
| 14. 选择题 | 详细信息 |
|
下列关于0.1mol/LH2SO4溶液的叙述错误的是 A.1L该溶液中含有H2SO4的质量为9.8g B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L |
|
| 15. 选择题 | 详细信息 |
|
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( ) A. F2、K、SO2 B. Cl2、Al、S C. NO2、Na、Br2 D. HNO3、HCl、Fe2+ |
|
| 16. 选择题 | 详细信息 |
|
下列选项中,与物质体积大小无关的因素是 A. 粒子数目 B. 粒子大小 C. 粒子之间的距离 D. 粒子的化学性质 |
|
| 17. 选择题 | 详细信息 |
|
取用下列药品必须用药匙的是( ) A.盐酸 B.锌粒 C.碳酸钠粉末 D.块状石灰石 |
|
| 18. 选择题 | 详细信息 |
|
某同学制得的氢氧化铁胶体中含有少量盐酸,为得到纯净的胶体,他设计了以下操作,合理的是( ) A.加入少量氢氧化钠溶液进行中和 B.加入硝酸银溶液反应后过滤 C.装入半透膜袋中,扎紧袋口,将其全部浸入蒸馏水中,并每隔一段时间,更换一次蒸馏水 D.在氢氧化铁胶体中插入石墨电极,通入直流电进行电泳后再过滤 |
|
| 19. | 详细信息 |
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是 A. a、b两处的混合气体成分含量相同,温度不同 B. c、d两处的混合气体成分含量相同,温度不同 C. 热交换器的作用是预热待反应的气体,冷却反应后的气体 D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率 |
|
| 20. 选择题 | 详细信息 |
|
向氧化铁、氧化铜、铁、铜的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( ) A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+ C.一定有Fe2+,可能有Cu2+ D.只有Fe2+ |
|
| 21. 选择题 | 详细信息 |
|
将100 mL某物质的量浓度的盐酸逐滴加入到100 mL 2 mol·L-1的碳酸钠溶液中,下列说法正确的是 ( ) A.开始加入盐酸时有气体放出,盐酸过量后无气体放出 B.加入盐酸时,开始无气体放出,最后有气体放出 C.盐酸浓度为2 mol·L-1时,放出二氧化碳4.4 g D.盐酸浓度为5 mol·L-1时,放出二氧化碳0.2 mol |
|
| 22. 选择题 | 详细信息 |
下图是关于蒸发的实验示意图,下列说法正确的是( ) A. 组装实验装置时,应先固定好铁圈,放上蒸发皿,再放酒精灯 B. 给蒸发皿内所盛液体加热时,必须垫上石棉网 C. 玻璃棒的作用是搅拌,防止因局部过热而使固体迸溅 D. 蒸发的过程中,用酒精灯一直加热到全部固体析出,没有水分 |
|
| 23. 选择题 | 详细信息 |
|
将表面已完全钝化的铝条,插入下列溶液中,一段时间后不会有气泡冒出的是 A. 稀硫酸 B. 稀盐酸 C. 浓硫酸 D. 氢氧化钠溶液 |
|
| 24. 填空题 | 详细信息 |
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。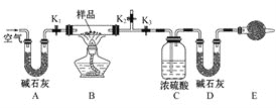 (1)实验步骤: ①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。 ②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。 ③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。 ④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。 ⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。 (2)关于该实验方案,请回答下列问题。 ①若加热反应后不鼓入空气,对测定结果的影响是_______________。 ②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。 ③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。 |
|
| 25. 推断题 | 详细信息 |
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)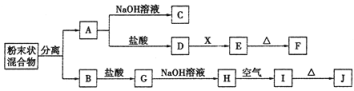 (1)写出下列物质的化学式:F____________,G________________。 (2)将混合物中两种金属分离开的最简单的方法是___________。 (3)D→E的转化中,加入过量的X可能是_____________________。 A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液 (4)写出下列转化的化学方程式: A→C:______________________________________________; H→I:_______________________________________________。 |
|
| 26. 推断题 | 详细信息 |
|
有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。 (1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。 (2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。 (3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。 |
|
| 27. 推断题 | 详细信息 |
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。 请回答下列问题: (1)E和J的化学式分别是________和________。 (2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。 (3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。 (4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。 |
|
最近更新



