2018至2019年高一下册期末考试化学考试完整版(云南省普洱市孟连县一中)
| 1. 选择题 | 详细信息 |
|
设阿伏加德罗常数的值为NA,下列说法正确的是( ) A. 1 mol氯气参加氧化还原反应时转移电子数一定是2NA B. 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA C. 同温同压下,等质量的H2和O2的体积之比是16∶1 D. 1 mol的Na2O2固体中含有离子数为4NA |
|
| 2. 选择题 | 详细信息 |
|
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓 度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为 ( ) A. 6:3:2 B. 3:2:1 C. 1:1:1 D. 9:3:1 |
|
| 3. 选择题 | 详细信息 |
|
运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应5KClO3+6P===3P2O5+5KCl,下列有关该反应的叙述错误的是( ) A. KClO3是氧化剂 B. P2O5是氧化产物 C. 1 mol KClO3参加反应有6 mol e﹣转移 D. 每有6 mol P被还原,生成5 mol KCl |
|
| 4. 选择题 | 详细信息 |
|
已知:2Fe2++Cl2===2Cl﹣+2Fe3+,2Br﹣+Cl2===Br2+2Cl﹣,2Fe2++Br2===2Br﹣+2Fe3+。含有amol FeBr2的溶液中,通入xmol Cl2,下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( ) A. x=0.4a,2Fe2++Cl2===2Fe3++2Cl﹣ B. x=0.6a,2Br﹣+Cl2===Br2+2Cl﹣ C. x=a,2Fe2++2Br﹣+2Cl2===Br2+2Fe3++4Cl﹣ D. x=1.5a,2Fe2++4Br﹣+3Cl2===2Br2+2Fe3++6Cl﹣ |
|
| 5. 选择题 | 详细信息 |
|
已知金属钠的活泼性非常强,甚至在常温时能和水发生反应2Na+2H2O===2NaOH+H2↑。现将9.2克钠、7.2克镁、8.1克铝分别放入100克10.95%的盐酸中,同温同压下产生气体的质量比是( ) A. 1∶2∶3 B. 4∶3∶3 C. 8∶6∶9 D. 1∶1∶1 |
|
| 6. 选择题 | 详细信息 |
|
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO A. 该物质属于两性氢氧化物 B. 该物质是Al(OH)3和Na2CO3的混合物 C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H D. 该药剂不适合于胃溃疡患者服用 |
|
| 7. 选择题 | 详细信息 |
|
最近全面通车的沪昆高速铁路是国家重要的交通线路,在工程建设中用量最大的硅酸盐材料是( ) A. 钢筋 B. 水泥 C. 玻璃 D. 陶瓷 |
|
| 8. 选择题 | 详细信息 |
|
取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) A.这种软锰矿石中MnO2的质量分数为75% B.被氧化的HCl的物质的量为4mol C.参加反应的HCl的质量为146g D.被还原的MnO2的物质的量为1mol |
|
| 9. 选择题 | 详细信息 |
|
已知元素的原子序数,不可以推断元素原子的( ) A. 质子数 B. 核电荷数 C. 核外电子数 D. 离子所带的电荷数 |
|
| 10. 选择题 | 详细信息 |
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是 A. 原子半径:W<X<Y B. 非金属性:Y>Z>X C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键 |
|
| 11. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B. 放热反应在常温下一定很容易发生 C. 甲烷的二氯代物不存在同分异构体,说明甲烷是正四面体结构而不是平面正方形结构 D. 由C(石墨,s)==C(金刚石,s)反应吸热可知,金刚石比石墨稳定 |
|
| 12. 选择题 | 详细信息 |
|
纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn 和 Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O=2Ag+ZnO。关于该电池下列叙述不正确的是( ) A. 正极的电极反应为Ag2O+2e‾+H2O=2Ag+2OH‾ B. Zn极发生氧化反应,Ag2O极发生还原反应 C. 使用时电子由Zn极经外电路流向Ag2O极,Zn是负极 D. 使用时溶液中电流的方向是由Ag2O极流向Zn极 |
|
| 13. 选择题 | 详细信息 |
|
下列措施对增大反应速率明显有效的是( ) A. 钠与无水乙醇反应时,增大无水乙醇的用量 B. 锌与稀硫酸反应制取氢气时,改用98%的浓硫酸 C. 在硫酸钾与氯化钡两溶液反应时,增大压强 D. 将炭块磨成炭粉用于燃烧 |
|
| 14. 选择题 | 详细信息 |
|
下列化合物的一氯代物的数目排列顺序正确的是( ) ①CH3CH2CH2CH2CH2CH3 ②(CH3)2CHCH(CH3)2 ③(CH3)3CCH2CH3 ④(CH3)3CC(CH3)3 A. ①>②>③>④ B. ②>③=①>④ C. ③>②>④>① D. ③=①>②>④ |
|
| 15. 选择题 | 详细信息 |
关于下图所示有机物(碳、氢、氧三种元素组成)的叙述不正确的是( ) A. 相对分子质量为88 B. 分子中含羧基官能团 C. 具有香味的无色油状液体 D. 乙酸与乙醇酯化反应的产物 |
|
| 16. 选择题 | 详细信息 |
|
只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液,该试剂是 A.NaOH溶液 B.Na2CO3溶液 C.碘水 D.新制氢氧化铜 |
|
| 17. 选择题 | 详细信息 |
|
化学与生活、生产、环境等密切相关。下列说法错误的是 A. 煤的液化、石油的裂化和油脂的皂化都属于化学变化 B. 棉、丝、毛、油脂都是天然有机高分子化合物 C. 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 D. 海水淡化的方法有蒸馏法、电渗析法等 |
|
| 18. 选择题 | 详细信息 |
|
甲:在试管中加入1 g粉末状大理石,加入4 mol/L盐酸20 mL(过量); 乙:在试管中加入2 g颗粒状大理石,加入4 mol/L盐酸20 mL(过量); 下列CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图合理的是   A. A B. B C. C D. D |
|
| 19. 选择题 | 详细信息 |
|
金属矿物通常色彩缤纷、形状各异。下列冶炼金属的方法属于热还原法的是( ) A. 2NaCl(熔融)==2Na+Cl2↑ B. WO3+3H2==W+3H2O C. Fe+CuSO4===Cu+FeSO4 D. 2Ag2O==4Ag+O2↑ |
|
| 20. 选择题 | 详细信息 |
|
下列关于硅及其化合物的叙述正确的是( ) A. 硅晶体可用于制造光导纤维 B. 陶瓷、玻璃、水泥都是硅酸盐产品 C. 二氧化硅在电子工业中是重要的半导体材料 D. 二氧化硅与氢氟酸和氢氧化钠均能反应,属于两性氧化物 |
|
| 21. 选择题 | 详细信息 |
|
向300 mL 1 mol·L-1的稀硝酸中,加入5.6 g铁粉,充分反应后,铁粉全部溶解(假设还原产物只有NO),下列说法不正确的是( ) A. 最终所得溶液中既有Fe2+又有Fe3+ B. 最终溶液中,硝酸无剩余 C. 标准状况下生成NO的体积为1.68 L D. 再向最终所得溶液中滴加稀硝酸,无明显变化 |
|
| 22. 选择题 | 详细信息 |
|
某有机物M的结构简式为CH3CH=CHCH2COOH,下列有关说法正确的是( ) A. 能与乙醇发生酯化反应 B. 不能使酸性高锰酸钾溶液褪色 C. 能与溴的四氯化碳溶液发生取代反应 D. 1 mol M与足量Na完全反应能生成1 mol H2 |
|
| 23. 计算题 | 详细信息 |
|
填写下列空白: (1)一定质量的Al2(SO4)3中含有2.7 g Al3+,含有________个SO42-;溶于水得100 mL溶液,所得溶液的物质的量浓度为________ mol·L-1。 (2)同温同压下,同质量的CO2和SO2,它们的密度之比为________,氧原子数之比为________。 (3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。 (4)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。 (5)已知ag A和bg B恰好完全反应生成0.2 mol C和dg D,则C的摩尔质量为____________。 |
|
| 24. 综合题 | 详细信息 |
氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: (1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。 (2)负极反应式为________________________________________________________________。 (3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑ ①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。 ②金属锂吸收的氢气与放出的氢气的物质的量之比为________。 |
|
| 25. 实验题 | 详细信息 |
某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。 (1)写出装置B中指定仪器的名称a________,b_________。 (2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。 (3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题 ①处所发生反应的离子方程式:____________________; ②处的现象:____________________; ③处所发生反应的离子方程式:__________________________。 (4)装置D中④的作用是__________________。 (5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。 |
|
| 26. 综合题 | 详细信息 |
已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 图1 (1)写出下列物质的官能团名称: B:____________________;D:____________________。 (2)反应④的化学方程式为________________________________________________,反应类型:________。 (3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。 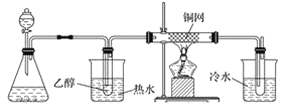 甲 乙 丙 丁 图2 ①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。 A Na2O2 B KCl C Na2CO3 D MnO2 ②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。 ③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。 |
|
| 27. 推断题 | 详细信息 |
A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系: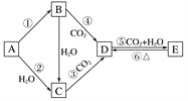 (1)推断各符号所代表的物质的化学式: A____________,B____________,C____________,D____________,E____________。 (2)分别写出反应②、⑤的化学方程式: ②______________________________________, ⑤__________________________________________。 (3)写出反应③的离子方程式____________________________________________。 |
|
| 28. 推断题 | 详细信息 |
A、B是两种有刺激气味的气体。试根据下列实验事实填空。 (1)写出A~F各物质的化学式: A__________、B__________、C__________、D__________、E__________、F__________。 (2)写出A、B跟水反应的离子方程式:______________________。 |
|
| 29. 推断题 | 详细信息 |
已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题: (1)操作⑥、操作⑦的名称分别为________、________。 (2)下列物质中沸点最高的是________。 A 汽油 B 煤油 C 柴油 D 重油 (3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号) (4)写出结构简式:A________、F________。 (5)写出反应③的离子方程式:___________。 (6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。 |
|
最近更新



