2018-2019年高二上册期末考试化学免费试卷(云南省普洱市景东县第一中学)
| 1. 选择题 | 详细信息 |
|
前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。已知H2O2的结构式为H—O—O—H,下列说法中不正确的是( ) A. H2NCONH2与H2O2是通过氢键结合的 B. H2O2分子中只含σ键,不含π键 C. H2O2既有氧化性又有还原性 D. H2NCONH2·H2O2属于离子化合物 |
|
| 2. 选择题 | 详细信息 |
|
下列说法中正确的是 A. 1s电子云呈球形,表示电子绕原子核做圆周运动 B. 电子云图中的小黑点密度大,说明该原子核外空间电子数目多 C. ns能级的原子轨道图可表示为 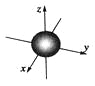 D. 3d3表示3d能级有3个轨道 |
|
| 3. 选择题 | 详细信息 |
|
下列元素一定是主族元素的是( ) A. 原子核外N电子层上只有一个电子的元素 B. 原子核外M层电子数为偶数的元素 C. 原子核外M层电子数为小于或等于7的奇数的元素 D. 原子核外N层电子数为2的元素 |
|
| 4. 选择题 | 详细信息 |
|
不能作为判断元素的非金属性强弱依据的是( ) A. 元素的最高价氧化物对应水化物的酸性强弱 B. 元素的单质跟氢气反应生成气态氢化物的难易程度 C. 非金属元素对应的气态氢化物的稳定性 D. 非金属元素单质的熔点和沸点的高低 |
|
| 5. 选择题 | 详细信息 |
|
下列物质属于原子晶体的化合物是( ) A. 金刚石 B. 刚玉 C. 二氧化硅 D. 干冰 |
|
| 6. 选择题 | 详细信息 |
|
根据等电子原理,下列分子或离子与SO42-有相似结构的是( ) A. PCl5 B. CCl4 C. NF3 D. NH3 |
|
| 7. 选择题 | 详细信息 |
|
下列有关范德华力的叙述正确的是( ) A. 范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键 B. 范德华力与化学键的区别是作用力的强弱不同 C. 任何分子间在任意情况下都会产生范德华力 D. 范德华力非常微弱,故破坏范德华力不需要消耗能量 |
|
| 8. 选择题 | 详细信息 |
|
对SO3的说法正确的是( ) A. 结构与NH3相似 B. 结构与SO2相似 C. 结构与BF3相似 D. 结构与P4相似 |
|
| 9. 选择题 | 详细信息 |
|
下列说法中不正确的是( ) A. 一般情况下,σ键比π键重叠程度大,形成的共价键强 B. 两个原子间形成共价键时,最多有一个σ键 C. 在气体单质中,一定有σ键,可能有π键 D. N2分子中有1个σ键,2个π键 |
|
| 10. 选择题 | 详细信息 |
|
下列关于化学键的叙述中正确的是( ) A. 化学键存在于原子之间,也存在于分子之间 B. 两个原子之间的相互作用叫做化学键 C. 离子键是阴、阳离子之间的相互吸引力 D. 化学键通常是指相邻的两个或多个原子之间强烈的相互作用 |
|
| 11. 选择题 | 详细信息 |
|
已知SO3,BF3,CCl4,PCl5、SF6都是非极性分子,而H2S,NH3,NO2、SF4,BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是( ) A. ABn型分子中A,B均不含氢原子 B. A元素的相对原子质量必小于B元素的相对原子质量 C. 分子中所有原子都在同一平面上 D. ABn型的价电子对数等于n |
|
| 12. 选择题 | 详细信息 |
晶胞是构成晶体的基本重复单元.在二氧化硅晶胞中有8个硅原子位于立方晶胞的8个顶角,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内.根据图示二氧化硅晶胞结构,每个晶胞内所含“SiO2”基元数为( )  A. 4个 B. 6个 C. 8个 D. 18个 |
|
| 13. 选择题 | 详细信息 |
|
下列各组粒子半径大小的比较中错误的是( ) A. K>Na>Li B. Na+>Mg2+>Al3+ C. Mg2+>Na+>F- D. Cl->F->F |
|
| 14. 选择题 | 详细信息 |
|
氯化硼的熔点为﹣107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( ) A.氯化硼液态时能导电而固态时不导电 B.氯化硼加到水中使溶液的pH升高 C.氯化硼分子呈正三角形,属非极性分子 D.氯化硼遇水蒸气会产生白雾 |
|
| 15. 选择题 | 详细信息 |
|
根据科学人员探测,在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物。有关其组成的两种分子的下列说法正确的是( ) A. 它们都是极性键构成的极性分子 B. 它们之间以氢键结合在一起 C. 它们的成键电子的原子轨道都是sp3—s D. 它们的立体结构都相同 |
|
| 16. 选择题 | 详细信息 |
|
下列关于晶体的说法中,不正确的是( ) A. 凡有有规则外形的固体一定是晶体 B. 晶胞是晶体结构的基本单元 C. 晶体内部的微粒按一定规律做周期性重复排列 D. 晶体尽量采取密堆积方式,以使其变得比较稳定 |
|
| 17. 选择题 | 详细信息 |
|
下列分子中所有原子都满足最外层8电子结构的是( ) A. 光气(COCl2) B. 六氟化硫 C. 二氟化氙 D. 三氟化硼 |
|
| 18. 选择题 | 详细信息 |
|
某元素的原子核外有三个能层,最外层有4个电子,该原子核内的质子数为 A. 14 B. 15 C. 16 D. 17 |
|
| 19. 选择题 | 详细信息 |
|
下列原子中未成对电子最多的是( ) A. C B. O C. N D. Cl |
|
| 20. 选择题 | 详细信息 |
|
下列分子中,既含有σ键,又含有π键的是 A.CH4 B.HCl C.CH2===CH2 D.F2 |
|
| 21. 选择题 | 详细信息 |
|
前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 A. 3种 B. 4种 C. 5种 D. 6种 |
|
| 22. 选择题 | 详细信息 |
|
据报道,月球上有大量3He存在。下列关于3He的说法正确的是( ) A. 是4He的同分异构体 B. 比4He多一个中子 C. 是4He的同位素 D. 比4He少一个质子 |
|
| 23. 选择题 | 详细信息 |
|
下列有关核外电子的运动状态的说法中错误的是( ) A. 电子亚层(能级)是描述电子运动的电子云状态 B. 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来 C. 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数 D. 电子云伸展方向与能量大小是无关的 |
|
| 24. 填空题 | 详细信息 |
|
Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。 (1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。 ①画出配离子[Cu(OH)4]2+中的配位键__。 ②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__(填序号)。 A.离子键 B.金属键 C.极性共价键 D.非极性共价键 (2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________. (3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):  ①H、O、N三种元素的电负性从大到小的顺序____。 ②乙二胺分子中N原子成键时采取的杂化类型是__。 ③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__。 |
|
| 25. 综合题 | 详细信息 |
|
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。 (1)写出基态Cu+的核外电子排布式___________________________________。 (2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。  (3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。 (4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。 |
|
| 26. 计算题 | 详细信息 |
|
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞共用。金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量(单位:g·mol-1)。 (1)金晶体每个晶胞中含有________个金原子。 (2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_________。 (3)一个晶胞的体积为________cm3。 (4)金晶体的密度为________g·cm-3。 |
|
| 27. 推断题 | 详细信息 |
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。 根据信息回答下列问题: (1)周期表中基态Ga原子的最外层电子排布式为____________。 (2)Fe元素位于周期表的________分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为________和________(填化学式)。 (3)在CH4,CO,CH3OH中,碳原子采取sp3杂化的分子有________________。 (4)根据VSEPR理论预测ED |
|
| 28. 推断题 | 详细信息 |
A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题: ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:(1)写出下列元素的符号:A__________,B__________,C__________,D__________。 (2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。 (3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。 (4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。 (5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。 |
|
最近更新



