高一上半期12月月考化学免费试卷完整版(2019-2020年福建省厦门第一中学)
| 1. 选择题 | 详细信息 |
|
实验室里需储存在棕色试剂瓶中的是 A.金属钠 B.浓硝酸 C.FeSO4溶液 D.浓硫酸 |
|
| 2. 选择题 | 详细信息 |
|
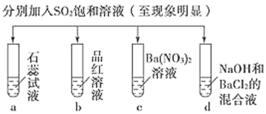
下列各组物质:① A.只有③④ B.只有①③⑤ C.只有①⑤ D.只有①③④⑤ |
|
| 3. 选择题 | 详细信息 |
|
稀硫酸插入一块铜片,加入下列物质后,可使铜片迅速腐蚀的是:( ) A.稀盐酸 B. |
|
| 4. 选择题 | 详细信息 |
|
下列说法正确的是( ). A.液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质 B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 C.蔗糖、酒精在液态和水溶液里均不导电,所以它们是非电解质 D.铜、石墨均导电,所以它们是电解质 |
|
| 5. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||
下列实验报告记录的实验现象正确的是( )
|
|||||||||||||||||||||||||||||||||
| 6. 选择题 | 详细信息 |
|
A. B. C. D. |
|
| 7. 选择题 | 详细信息 |
|
欲使 A.通入二氧化碳气体 B.加入氢氧化钠固体 C.通入氯化氢气体 D.加入饱和石灰水溶液 |
|
| 8. 选择题 | 详细信息 |
|
碳纳米管是由石墨的一层网状结构卷曲成的单层或多层管状结构,是继 A.碳纳米管和 C.碳纳米管和石墨的结构和性质都相同 D.碳纳米管能在氧气中燃烧生成二氧化碳 |
|
| 9. 选择题 | 详细信息 |
下图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是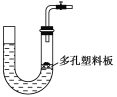 A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气 C.浓盐酸和二氧化锰制取氯气 D.固体NH4Cl和消石灰制取氨气 |
|
| 10. 选择题 | 详细信息 |
下面是实验室制取氨气的装置和选用的试剂,其中错误的是( ) A. ①② B. ②③ C. ③④ D. ①③ |
|
| 11. 选择题 | 详细信息 |
|
下列可以大量共存且溶液是无色的离子组是:( ) A. C. |
|
| 12. 选择题 | 详细信息 |
|
下列各组物质的稀溶液,不用其他试剂就能一一区别开来的是:( ) ① A.①② B.③ C.④ D.③④ |
|
| 13. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是:( ) A.足量碳酸氢钠溶液与少量澄清石灰水反应: B.铁片溶于足量稀硝酸: C.氢氧化镁与稀硫酸反应: D.碳酸氢铵与足量的 |
|
| 14. 选择题 | 详细信息 |
|
下列有关化学实验的叙述正确的是:( ) A. B.配制 C.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 D.配制一定物质的量浓度的溶液,定容时仰视刻度线会使所配制的溶液浓度偏高 |
|
| 15. 选择题 | 详细信息 |
|
向含有 A.反应后溶液的酸性减弱 B.有 C.该反应中起氧化作用的是 D.用过二硫酸钾 |
|
| 16. 选择题 | 详细信息 |
|
已知反应:① A.上述三个反应都有单质生成,所以都是置换反应 B.氧化性由强到弱的顺序为 C.反应②中还原剂与氧化剂的物质的量之比为6:1 D.若反应③中1mol还原剂参加反应,则氧化剂得到电子的物质的量为2mol |
|
| 17. 选择题 | 详细信息 |
|
中学化学常见物质存在转化关系:A+B→C+D+H2O,其中C属于盐类,下列推断不正确的是 A.若A为黄绿色气体,则D可能有漂白性 B.若A为红色金属单质,则D一定是红棕色气体 C.若A为纯碱,则D一定能使澄清石灰水变浑浊 D.若A为氯化铵,则D一定是具有刺激性气味的气体 |
|
| 18. 选择题 | 详细信息 |
|
现有25 mL 2 mol·L-1Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况( ) A.均为0.84 L B.均为0.56 L C.①>② D.②>① |
|
| 19. 选择题 | 详细信息 | |||||||||||||||||||||||||
用图装置进行下列实验,不能得出相关实验现象的是:( )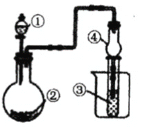
|
||||||||||||||||||||||||||
| 20. 选择题 | 详细信息 | ||||||||||||||||||||||||
将甲、乙两种气体同时通入过量的丙溶液中,可能产生沉淀的组合是
|
|||||||||||||||||||||||||
| 21. 选择题 | 详细信息 |
|
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 A. 60mL B. 45mL C. 30mL D. 15mL |
|
| 22. 选择题 | 详细信息 |
|
某溶液可能含有 A.该溶液中最多存在4种离子 B.该溶液中不能确定是否存在 C.该溶液一定存在 D.该溶液由 |
|
| 23. 填空题 | 详细信息 |
|
按要求写出下列反应的化学或离子方程式。 (1)工业合成氨的化学方程式为____________ (2)铜与稀硝酸反应的离子方程式为______________ (3)氨气催化氧化的化学方程式为____________ (4)实验室制备 (5)腐蚀印刷电路板的离子方程式为_____________ |
|
| 24. | 详细信息 |
|
按要求填空。 (1)同温同压下,同体积的甲烷 (2)对于司机酒后驾车,可取其呼出的气体进行检验而查出,所利用的化学方程式如下:2CrO3-(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O,上述反应中的还原剂是___________。 (3)在相同条件下, (4) (5)过氧化氢的水溶液,俗名双氧水,医疗上利用它的杀菌消毒作用来清洗伤口。将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消失,此时双氧水表现出___性,发生反应的离子方程式为____ (6)按反应式 (7)某温度下,将 (8)向一定量的 |
|
| 25. 填空题 | 详细信息 |
|
现有下列十种物质:①铝 ②蔗糖 ③ (1)上述物质中属于非电解质的有____。(填序号) (2)⑨在水中的电离方程式为_______。 (3)向⑥中逐渐滴加⑦的溶液,看到的现象是_______。 (4)上述物质中有两种物质在水溶液中发生反应,其离子方程式可表示为: (5)二氧化硫通入⑧溶液中,溶液会褪色。写出并配平反应的离子方程式:____。 |
|
| 26. 实验题 | 详细信息 |
|
喷泉是一种常见的现象,其产生原因是存在压强差。 (1)图Ⅰ为化学教学中常用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。将胶头滴管中的液体挤入烧瓶内,轻轻振荡烧瓶,然后打开止水夹  A. (2)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是______ A. (3)比较图I和图Ⅱ两套装置,从产生喷泉的原理来分析,图I是上部烧瓶内气体压强____;图Ⅱ是下部锥形瓶内气体压强_____(均填“增大”或“减小”)。 (4)某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置。 ①如果关闭活塞 ②在①操作的基础上,若要在该装置中产生双喷泉现象,其操作方法是______ |
|
| 27. 实验题 | 详细信息 |
某学生利用以下装置探究氯气与氨气之间的反应,其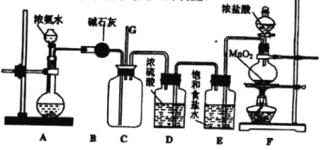 (1)装置 (2)装置 A.生石灰 B.二氧化硅 C.五氧化二磷 D.烧碱 (3) (4)通入 (5)装置 (6)从装置 |
|
| 28. 综合题 | 详细信息 |
高铁酸钾(K2FeO4) 是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: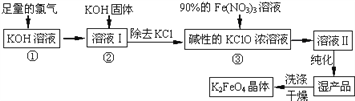 (1)反应①应在温度较低的情况下进行(因在温度较高时KOH 与Cl2 反应生成的是KClO3。)写出①的化学方程式_____________________。 (2)在溶液I中加入KOH 固体的目的是_____________________。(填编号) A.与反应液I中过量的Cl2继续反应,生成更多的KClO B.KOH 固体溶解时会放出较多的热量,有利于反应进行 C.为下一步反应提供碱性的环境 D.使KClO3 转化为KClO (3)从溶液Ⅱ中分离出K2FeO4 后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________________________________________。 (4)如何判断K2FeO4 晶体已经洗涤干净___________________。 |
|
最近更新