2019届初三下半年3月月考化学专题训练(江苏省无锡市阳山中学)
| 1. 选择题 | 详细信息 |
|
下列选项中,不利于生态环境保护的是 ( ) A. 保护绿水青山,建设生态文明 B. 分类处理垃圾,回收利用资源 C. 骑行共享单车,倡导绿色出行 D. 随意排放污水,降低生产成本 |
|
| 2. 选择题 | 详细信息 |
|
下列实验操作中,不正确的是( ) A. 加热液体  B. 测定溶液的pH B. 测定溶液的pH C. 稀释浓硫酸  D. 检查气密性 D. 检查气密性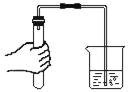 |
|
| 3. 选择题 | 详细信息 |
|
有关实验现象的描述正确的是 A. 硫在空气中燃烧发出明亮的蓝紫色火焰 B. 铁丝在氧气中剧烈燃烧,火星四射 C. 干冰在空气中升华,周围出现白色烟雾 D. 碳在空气中剧烈燃烧,发出白光 |
|
| 4. 选择题 | 详细信息 |
|
过氧化氢(H2O2)俗称双氧水,是一种液体,易分解,常作氧化剂、漂白剂和消毒剂。为了便于贮存、运输和使用,工业上常将它转化为固态的过碳酸钠晶体(2Na2CO3·3 H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是 ( ) A. MnO2 B. CaCl2 C. 稀盐酸 D. NaHCO3 |
|
| 5. 选择题 | 详细信息 |
|
脑黄金的化学式为C25H51COOH。下列对脑黄金的说法正确的是 A. 该物质的相对分子质量为396g B. 该物质中碳、氧元素质量比26︰2 C. 该物质中氢元素质量分数最大 D. 该物质是由碳、氢、氧三种元素组成 |
|
| 6. 选择题 | 详细信息 |
图是A、B、C三种物质的溶解度曲线,下列分析正确的是 ( ) A. A的溶解度比B大 B. 50℃时把50gA放入100g水中能得到A的饱和溶液,其中溶质与溶液的质量比为1:2 C. 将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C D. 将A的饱和溶液变为不饱和溶液,可采用升温的方法 |
|
| 7. 选择题 | 详细信息 | ||||||||
善于归纳知识,有利于提高学习能力。下列知识整理的内容不完全正确的一组是( )
|
|||||||||
| 8. 选择题 | 详细信息 |
构建模型是化学学习常用的方法。如图为某化学反应的微观模拟示意图,请判断下列说法,不正确的是 ( ) 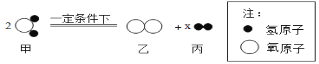 A. 物质丙的化学式为H2 B. x的数值为2 C. 该反应中分子和原子的种类都发生了改变 D. 反应前后氧元素的化合价发生了改变 |
|
| 9. 选择题 | 详细信息 | ||||||||||||||||||||
除去下列物质中的少量杂质,所选用的试剂及操作方法均不正确的是 ( )
|
|||||||||||||||||||||
| 10. 填空题 | 详细信息 |
(1)从化学视角回答下列问题: ①飞机风挡玻璃是由四层平板钢化玻璃夹有机合成材料PVB胶片制成。钢化玻璃是由SiO2与Na2CO3在高温下反应制成玻璃,再经特殊工艺处理得到的。则风挡玻璃属于_____(填序号)。 A 合金 B 无机化合物 C 复合材料 D 有机高分子材料 ②飞机发生意外后,乘客座位上方的氧气面罩掉下,乘客戴上氧气面罩的作用是________。 ③飞机机身大量使用铝合金,铝合金耐腐蚀好的原因_______________。(方程式) ④飞机使用航空煤油作燃料,航空煤油是_____炼制的产品。 (2)H、O、C、Ca是初中化学常见的几种元素,请选用适当的元素写出符合下列要求的物质的化学式. ①常用于人工降雨的氧化物________; ②用作补钙剂的盐_______; ③可用于改良酸性土壤的碱_________; ④汽水中的酸___________。 |
|
| 11. 科学探究题 | 详细信息 |
请根据下列装置图,回答有关问题: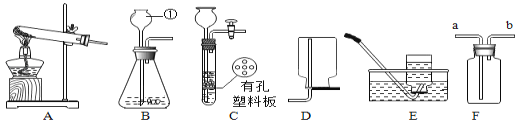 (1)写出图中标号仪器的名称:①__________; (2)实验室用高锰酸钾制氧气,发生装置应选____,实验时,需对该装置做一点改动_。写出用高锰酸钾制氧气的化学方程式___________________;若用F 装置收集氧气,如何验满?______________________________________________ (3)用C装置代替B装置制取氢气的优点是_______________;写出实验室制氢气的化学方程式 _______________________________; (4)亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取N2。N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3。下图为制取少量NH3的装置(制取H2的装置已略去)。 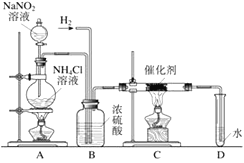 ①C装置的硬质试管中发生反应的化学方程式为________________________。 ②反应时N2和H2的最佳质量比是_________。如果按此比例进行反应,反应时,若D中导管口有气泡逸出,(已知NH3极易溶于水),说明逸出气泡的原因__________________。 ③用实验方法证明确实有NH3生成: ________________________________。 |
|
| 12. 流程题 | 详细信息 |
我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热到约800℃,得到黄铜(铜锌合金,外观似黄金),其流程如下: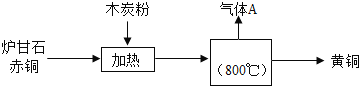 请回答下列问题: (1)赤铜矿中铜元素的化合价为_____; (2)区分黄铜与黄金的方法?(写出操作步骤、现象、结论)________________; (3)气体A中除CO2外,还有一种气体是_____(填化学式); (4)加热时,发生反应的化学方程式有:①ZnCO3═ZnO+CO2↑(条件:高温) ②C+2ZnO═2Zn+CO2↑(条件:高温) ③_____________;(木炭粉与赤铜的反应) 已知化学反应中,物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫做还原反应。在反应②中,ZnO发生_____(填“氧化”或“还原”)反应; |
|
| 13. 科学探究题 | 详细信息 | ||||||||||||||||||||||||||||||
|
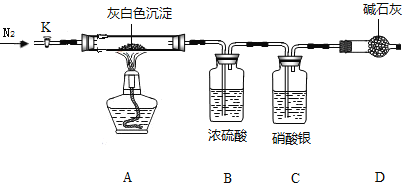
镁是初中化学中常见的一种金属。小莫同学欲探究镁的制备方法及镁的一些化学性质。 一、目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下: 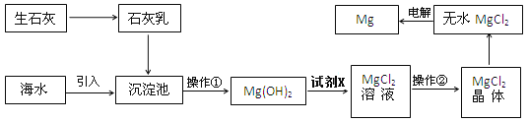 提示:①MgCl2晶体的化学式为MgCl2•6H2O; ②MgO的熔点为2852℃,无水MgCl2的熔点为714℃. (1)操作①的名称是 ___________ (2)试剂X的名称_____________ (3)用氯化镁电解生产金属镁的化学方程式为:___________________ (4)工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_____________________ 二、小莫同学用上述制得的镁与稀盐酸反应。 将打磨后的镁条放入盐酸中,观察到有灰白色沉淀生成的“异常”现象,引起了他的兴趣并进行了以下探究; (初步探究)出现灰白色沉淀是否为偶然现象 (实验Ⅰ)向4份相同体积与浓度的稀盐酸中加入一定长度的镁带,现象如下:
|
|||||||||||||||||||||||||||||||