武汉市九年级化学2019年下半年中考模拟网络考试试卷
| 1. | 详细信息 |
|
物质的性质决定其用途,下列关于物质的用途不正确的是 A. 干冰—人工降雨 B. 铜丝—作导线 C. 烧碱—治疗胃酸过多 D. 熟石灰—改良酸性土壤 |
|
| 2. | 详细信息 |
|
下列化学用语表示正确的是 A. 氨气中氮元素的化合价: C. 2个一氧化碳分子:2Co D. Fe与盐酸反应:2Fe+6HCl=2FeCl3+3H2↑ |
|
| 3. | 详细信息 |
|
规范的实验操作是实验成功的关键,下列实验操作正确的是 A. 铁丝在氧气中燃烧 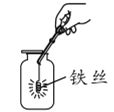 B. 干燥H2 B. 干燥H2 C. 量取18mL水 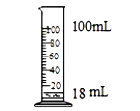 D. 蒸发 D. 蒸发 |
|
| 4. | 详细信息 | ||||||||
下面对所学部分化学知识进行归纳,其中完全正确的一组是
|
|||||||||
| 5. | 详细信息 |
|
甲、乙、丙、丁四种物质,存在关系:甲+乙→丙+丁。下列说法正确的是 A. 若甲为单质,则该反应一定是置换反应 B. 若该反应为复分解反应,则生成物中一定有水 C. 甲、乙、丙、丁可分属四种不同类别的化合物 D. 若甲为20g、乙为15g,则反应生成丙和丁的质量总和一定等于35g |
|
| 6. | 详细信息 |
|
化学是研究物质的组成、结构、性质和变化的科学,下列有关说法正确的是 ①物质的组成元素相同,则它们的化学性质一定相同②不同种元素组成的纯净物一定是化合物③元素是质子数相同的一类粒子的总称④分子可以分为原子,原子不能再分⑤具有均一性和稳定性的液体一定是溶液⑥金刚石、石墨、C60的性质有明显差异,是由于他们的原子排列方式不同⑦催化剂在参与化学反应前后,其本身的质量和性质均没有发生改变⑧有发光发热现象的变化一定是燃烧 A. ②③⑥⑦ B. ③④⑤⑥⑦⑧ C. ③④⑥⑦ D. ②⑥ |
|
| 7. | 详细信息 |
|
某中学初三化学兴趣小组为了探究NH3在不同环境下与O2的反应,进行图1和图2两组实验,同学们根据图2实验中气体成分分析数据,绘制了曲线图(见图3)。 (查阅资料) ①氨气是一种有刺激性气味的气体,在高浓度氧气中才能燃烧,生成氮气和水. ②在纳米级Cu2O的催化作用下,氨气与氧气在不同的温度下发生以下不同的化学反应: 4NH3+5O2═4NO+6H2O 4NH3+3O2═2N2+6H2O ③工业上用NO制备硝酸、氮肥等化工产品. 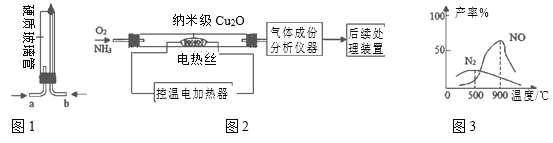 下列说法不正确的是 A. 图1实验中NH3从b管进,O2从a管进入;实验过程中要先通O2一段时间,再通NH3并点燃,可以避免NH3污染空气 B. 图2中在纳米级Cu2O的催化作用下,氨气与氧气发生的化学反应都属于氧化反应 C. 根据图3分析,在Cu2O催化作用下,400℃时以生产NO为主 D. 若利用后续处理装置模拟硝酸的工业制法,最好将电热丝的温度控制在900℃左右 |
|
| 8. | 详细信息 |
|
将一定量的金属M加入含有硝酸铝、硝酸亚铁、硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液,根据实验分析,下列说法正确的是 ①若滤液为浅绿色,则滤渣中一定不含Fe和M ②若滤液只含一种溶质,滤渣含有四种金属,则几种金属活动性顺序:M>Al>Fe>Ag ③若滤渣不含有M,当滤液中的溶质种类为3种时,M一定是Cu ④若滤渣含有M,则滤液中的溶质种类最多含4种,最少含一种 ⑤向滤渣中加入稀盐酸产生无色气体,则滤渣中一定含有Ag和Fe A. ①④ B. ② C. ②③⑤ D. ②④ |
|
| 9. | 详细信息 |
|
化学与生活密切相关,请你用化学知识解释下列现象:今天是豆豆爸爸的生日: (1)妈妈为爸爸斟了一杯白酒,豆豆远远就闻到了酒的特殊香味,请从微观的角度解释能闻到香味的原因___。 (2)豆豆帮忙点燃了生日蜡烛,蜡烛在燃烧过程中发生了____。(填字母) a物理变化 b化学变化 c既有物理变化,又有化学变化 (3)爸爸许愿后大家一起将蜡烛吹灭,这种熄灭蜡烛火焰的原理是___。 (4)面粉是制作蛋糕的主要原料,面粉中富含的营养素为____。 |
|
| 10. | 详细信息 |
亚硝酸钠(NaNO2)是一种工业用盐,有毒、有咸味,外形与食盐相似。下图是NaNO2、NaCl 的溶解度曲线。请回答下列问题: 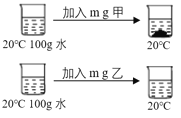 (1)根据溶解度曲线,某同学设计了鉴别 NaNO2、NaCl 固体的方案,如上图: ①由此可以判断甲是___(填化学式); ②m的取值范围为____。 (2)现有一杯125.0g溶质质量分数为20%的NaNO2溶液,若维持温度在20℃,要使该溶液变为饱和溶液,需要加入NaNO2固体____g。 (3)根据溶解度曲线,关于NaNO2和NaCl下列说法中正确的是____。 A 20℃时,等质量的两种固体加水配成饱和溶液,所得NaCl溶液的质量大 B 40℃时,NaNO2溶液的溶质质量分数大于NaCl溶液的溶质质量分数 C 60℃时,两种物质的饱和溶液降温到 20℃时,NaNO2的溶液中析出晶体较多 D 除去NaNO2固体中混有的少量NaCl,可以采用降温结晶的方法 |
|
| 11. | 详细信息 |
实验室有一包固体物质,可能含有氯化钠、硫酸钠、碳酸钾、硝酸钠和高锰酸钾中的一种或几种。为了确定该固体的成分,某化学小组的同学按下列框图进行实验。回答下列问题: (1)该固体中一定没有___(写化学式)。 (2)根据实验现象分析,第①步所得无色溶液的pH____7(填“>”、“=”或“<”)。 (3)为了不干扰对第③和④步实验结论的判断,试剂A应选择____(写试剂名称)。 (4)第③步发生的化学反应方程式为___。 (5)最后滤液中的溶质有___种。 |
|
| 12. | 详细信息 |
|
硫酸是一种重要的化工原料,也是实验室常用的化学试剂。工业上常常以黄铁矿(主要成分是FeS2)为原料生产硫酸。现欲测定某黄铁矿中FeS2的含量(杂质不参与反应),某兴趣小组的同学在老师的指导下,查阅资料:①4FeS2+11O2 I.称取1.60 g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应; II. 反应结束后,将乙瓶中的溶液进行如图处理。  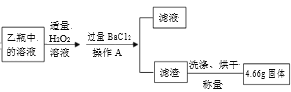 请回答下列问题: (1)甲瓶内NaOH溶液的作用是____。 (2)甲、乙两瓶内发生的化学反应类似,请写出乙瓶内发生反应的化学方程式____。 (3)操作A使用的玻璃仪器除烧杯外,还有____。 (4)最终得到的4.66g固体是____(写化学式)。 (5)该黄铁矿样品中FeS2的质量分数为___。 (6)如果缺少甲装置,则最终测得样品中FeS2的质量分数将会____(填“偏大”“偏小”“不变”)。 |
|
| 13. | 详细信息 |
某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定时(杂质不与盐酸反应),得到一黄色残液。为防止直接排放造成环境污染,对其组成进一步进行探究。过滤该残液,取100g滤液向其中不断加入5%的氢氧化钠溶液,所得沉淀与加入NaOH溶液质量的关系如下: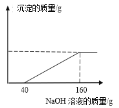 (1)由图像分析可知,该滤液中含有的溶质是____(写化学式)。 (2)选择合理的数据,计算100g滤液中溶质的质量___(若有多种溶质,任选一种。结果精确度0.01%)。 |
|
最近更新



