2015年广东省佛山市中考模拟化学专题训练
| 1. 选择题 | 详细信息 |
|
下列物质的用途主要利用其化学性质的是 A.氦气用于充填气球 B.硫酸铜和熟石灰用作农药“波尔多液” C.活性炭用作净水的吸附剂 D.干冰用于人工降雨 |
|
| 2. 选择题 | 详细信息 |
|
材料的研制代表了一个国家的工业最高水平。我国发射的神舟十号载人飞船,采用了一种新型的材料,其中一种航天材料是以铝镁为基体材料,将石墨作为增强材料分散在其中制得的具有特殊性能的材料,它属于( ) A.金属材料 B.复合材料 C.合成材料 D.无机非金属材料 |
|
| 3. 选择题 | 详细信息 |
|
广州医学院钟南山院士强调:H7N9禽流感发病5日内使用达菲可显著减少重症,禽流感患者越早治疗效果越好。“达菲”主要有效成分是莽草酸(C7H10O5),下列关于莽草酸说法正确的是( ) A. 属于氧化物 B. 由7个碳元素、10个氢元素、5个氧元素组成 C. 174g莽草酸中含有84g碳元素 D. 一个莽草酸分子中含有5个氧分子 |
|
| 4. 选择题 | 详细信息 |
|
下列做法或说法中不正确的是( ) A.用熟石灰降低土壤酸性,改良土壤结构 B.用过滤或蒸馏的方法能降低水的硬度 C.将煤球制成“蜂窝煤”是为了增大与空气的接触面积,使其燃烧更充分 D.使用可降解塑料代替传统塑料,有利于减轻“白色污染” |
|
| 5. 选择题 | 详细信息 |
|
据报道,中国正在研制的大推力运载火箭“长征五号”有望于2014年后发射月球车、大卫星和空间站,若“长征五号”燃料燃烧只有水生成,则应选用的燃料是 A.氢气 B.甲烷 C.汽油 D.乙醇 |
|
| 6. 选择题 | 详细信息 |
|
同学们参加了佛山市中考实验技能考查,切身体会到规范操作的重要性。下列实验操作符合规范要求的是( ) A.测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中 B.配制稀硫酸时,将水沿量筒壁慢慢注入浓硫酸中,并不断搅拌 C.配制一定溶质质量分数的溶液实验中,多余的药品应放回原瓶 D.高锰酸钾制取氧气实验中,收集好气体后应先将导管移出水槽再停止加热 |
|
| 7. 选择题 | 详细信息 |
|
今年5月12日是我国第六个“防灾减灾日”。以下有关处理火灾现场方法错误的是 A. 身上着火不可乱跑,要就地打滚使火熄灭 B. 用水浇湿毛巾或衣物,捂住口鼻,低姿行走到安全通道 C. 逃生路线被火封住,应退回室内,关闭门窗,向门窗浇水,发出求救信号 D. 人员被火势围困在高层建筑时使用楼内电梯撤退 |
|
| 8. 选择题 | 详细信息 | ||||||||||||||||||||
除去下列各组物质中的杂质,所用试剂和方法均正确的是( )
|
|||||||||||||||||||||
| 9. 选择题 | 详细信息 | |||||||||||||||
在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。下列关于此反应的认识,正确的是
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
|
推理是学习化学的重要思维方法,以下推理正确的是( ) A.酸中都有氢元素,所以含有氢元素的化合物一定是酸 B.碱性溶液能使石蕊试液变蓝色,所以能使石蕊试液变蓝色的溶液一定呈碱性 C.CO2通入CaCl2和NaOH混合溶液中变浑浊,则CO2通入CaCl2溶液也变浑浊 D.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 |
|
| 11. 选择题 | 详细信息 |
|
以下几种气体,不能用如图装置干燥并收集的是( ) ①H2 ②O2 ③CO2 ④SO2 ⑤CH4 ⑥HCl  A.①② B.①⑤ C.①③④ D.②③④⑥ |
|
| 12. 选择题 | 详细信息 | |||||||||||||||
现有a、b、c、d四种无色溶液,分别是氯化铵溶液、硫酸、氢氧化钡溶液、盐酸中的一种。根据下表中它们两两反应的实验记录,推断a、b、c、d分别是( )
|
||||||||||||||||
| 13. 选择题 | 详细信息 | |||||||||||||||
烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH变化如图所示。则符合该变化的一组物质是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
往CuSO4溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤渣中加入稀盐酸,有无色气体放出。下列分析正确的是( ) A.滤液中一定有CuSO4 、FeSO4 B.滤渣中一定有铁和铜 C.滤渣中一定有铜、可能有铁 D.滤液中一定有FeSO4 ,可能有 CuSO4 |
|
| 15. 选择题 | 详细信息 |
|
下列说法正确的是(以下的pH值均在通常情况下测定)( ) A.pH<5.6的雨水都是酸雨 B.稀氢氧化钠溶液加水稀释时,溶液的pH值会逐渐增大 C.10g 10.6%的Na2CO3溶液与10g 10.6%的CaCl2溶液混合后的pH>7 D.将40gNaOH固体加入100g 49%的硫酸溶液中,所得溶液的pH>7 |
|
| 16. 选择题 | 详细信息 |
已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高。海洋中有丰富的资源,如下图所示利用海水可获得许多化工产品。下列有关说法正确的是( ) A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液,过滤后加盐酸 B.第②步中加入的试剂为CaCl2溶液 C.第③步中发生分解反应 D.在第④步中溴元素被氧化 |
|
| 17. 填空题 | 详细信息 |
|
广州市食品药品监督管理局2013年5月16日公布餐饮环节一季度食品抽检数据,在抽检的18批次米及米制品产品中,有8批次产品镉超标。镉是一种重金属,会抑制人体钙质吸收。体内镉超标易患骨质疏松、骨痛病等病症。镉是银白色有光泽的金属,高温下也可与硫直接化合,生成硫化镉。氧化镉和氢氧化镉的溶解度都很小,它们溶于酸,但不溶于碱。认真阅读以上材料回答以下问题: (1)如图是镉(Cd)原子的构成示意图,根据图示信息回答下列问题:  ①图中X的值为_____,在化学反应中镉原子容易_____(“得到”或“失去”)电子:形成离子符号表示为_____。 ②镉原子与下列元素化学性质相似的是_____。 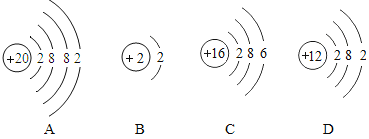 (2)写出镉与硫直接化合反应的化学方程式:_____。 (3)某企业想将含氢氧化镉的镉渣用硫酸处理掉,请你写出反应的化学方程式:_____。 |
|
| 18. 填空题 | 详细信息 |
|
氯酸钾(KClO3)和高锰酸钾(KMnO4)是初中常见的化学物质,在生活中也应用广泛,如高锰酸钾别名“灰锰氧”,在生活中常用作消毒剂等。根据所学知识回答: (1)氯酸钾和高锰酸钾都可以制取氧气,是因为它们的组成中都含有相同的_____。 (2)氯酸钾和高锰酸钾阳离子对应的碱都是_____(填化学式)。 (3)高锰酸钾在一定条件下能与浓盐酸反应,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5□↑+8H2O则“□”中的化学式为_____。 |
|
| 19. 填空题 | 详细信息 |
如图为硝酸钾和氯化钠的溶解度曲线。回答下列问题: (1)当温度为30℃时,硝酸钾的溶解度_____(填“>”、“<”或“=”)氯化钠的溶解度。 (2)将A点对应KNO3溶液从20℃升温到30℃(忽略水的蒸发),在此过程中,硝酸钾的溶质质量分数_____(选填“增大”、“减小”或“不变”)。 (3)将A点对应的100gKNO3溶液恒温蒸发10g水,可析出KNO3的质量为_____g。 |
|
| 20. 填空题 | 详细信息 |
|
家庭厨房实际上就是一个化学世界。“柴、米、油、盐、酱、醋、糖”等都是化学物质。请根据你所掌握的化学知识,结合厨房中的常用物质,回答下列问题: (1)“米”含有的营养素是_____;食盐是厨房中最重要的调味品,如果食盐中不加碘,则碘缺乏地区的人可能_____,食盐中的碘是指碘_____(填“分子”、“元素”或“原子”);餐具上的油污用加入洗洁精的水更易洗净,原因是_____。 (2)食醋主要含醋酸,醋酸与氢氧化钠溶液的反应方程式为:CH3COOH+NaOH=CH3COONa+H2O,则:醋酸与氢氧化镁的反应方程式为:_____。 (3)液化石油气不完全燃烧会产生一种有毒气体CO,因此,使用热水器时,防止发生中毒的做法是_____(写出一种即可)。 |
|
| 21. 推断题 | 详细信息 |
A是黑色固体,D为常见金属,这种金属元素是地壳中含量最多的金属元素,B为汽车铅蓄电池中含有的酸,C为蓝色溶液,D、E、F均为单质。如图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略。 (1)写出下列物质的化学式: B_____,C_____,F_____。 (2)反应①除了生成E,另一生成物的化学式_____。 (3)C和D反应后的溶液质量比反应前溶液质量_____(填“增加”、“减少’、”不变“)。 (4)写出反应②的化学方程式_____。 |
|
| 22. 流程题 | 详细信息 |
由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如下。 (1)上述流程中的物质属于金属氧化物的是___________________。 (2)步骤Ⅰ中,FeO和碳反应生成二氧化碳和铁,化学方程式是_____________,该反应中具有还原性的物质是 ________。 (3)步骤Ⅲ的基本反应类型是 _________。 (4)从MgCl2溶液到MgCl2·6H2O晶体的操作过程为 ________、冷却结晶、过滤冼涤、小心干燥。 |
|
| 23. 科学探究题 | 详细信息 |
用下图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片): (1)甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管_____(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。铁锈的主要成分是_____(用化学式表示)。 (2)试管D和E实验的目的是进一步探究铁在_____的环境中是否更容易锈蚀。 (3)欲除去铁锈可用_____洗的方法,铁制品除锈时_____(填“能”或“不能”)长期浸在酸液中。 (4)为防止金属锈蚀,除了采用覆盖保护膜等措施以外,还可以制成合金。这是因为合金与纯金属相比,其组成和内部组织结构发生变化,从而引起_____的变化。 |
|
| 24. 实验探究题 | 详细信息 |
某学习小组围绕“气体实验室制取”进行了研讨。请你参与完成下面的问题。 (1)实验室制取CO2的化学方程式为_____。不用稀硫酸与大理石反应制取CO2的原因是_____。 (2)图A装置中仪器a的名称是_____。实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图_____(填序号)发生装置。 (3)收集有毒气体SO2时,常采用图C收集装置,气体应从_____(填字母)端通入。 |
|
| 25. 实验探究题 | 详细信息 |
(1)某同学要用H2(其中含有水蒸汽)干燥后来还原8gCuO、并检验产物中有H2O生成,他设计了如下图所示的实验装置。请你将他设计的装置补画完整_____。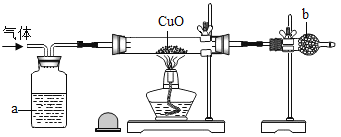 (2)图中试剂a是_____;按化学方程式计算,反应所需氢气的质量为2g,但事实是在实验中发现所用的氢气实际用量超过了2g,其原因是:_____。 (3)进行实验时,若发现酒精灯里有足够的酒精,却不能点燃,其可能的原因和处理方法是(至少写出一种):_____。 |
|
| 26. 科学探究题 | 详细信息 | ||||||||||
|
一包白色粉末,由CuSO4、NaOH、Na2CO3、CaCO3、NaCl中的两种或两种以上的物质组成。为了探究其组成,进行如下实验: (一)取少量白色粉末,向其中加入足量的水,充分搅拌,得到无色透明的溶液。则原白色粉末中一定不含有_____。 (二)为了进一步探究原白色粉末的组成,请你和小欣同学一起完成下列探究。 [小欣同学作了以下猜想]: 猜想I:白色粉末为Na2CO3和NaOH混合物; 猜想II:白色粉末为Na2CO3和NaCl混合物 猜想III:白色粉末为_____; 猜想IV:白色粉末为Na2CO3、NaOH和NaCl的混合物 [设计实验]
|
|||||||||||
| 27. 计算题 | 详细信息 |
|
“漂白粉”的有效成分为次氯酸钙(化学式为Ca(ClO)2)。请回答: (1)次氯酸钙中钙、氯、氧三种元素的质量比为_____。 (2)次氯酸钙中氯元素的质量分数是_____(精确到0.1%)。 (3)若灾区饮用水每50kg至少需要漂白粉250g,则消毒一桶水(约20kg)至少需要漂白粉_____g。 |
|
| 28. 科学探究题 | 详细信息 |
实验室有一瓶含有K2CO3和K2SO4的混合溶液,某化学兴趣小组设计实验来测定溶质的质量分数。他们经过讨论后设计了如下装置进行实验探究: a.按图组装仪器,检查气密性,把100g混合溶液加入锥形瓶中装好药品; b.打开A中活塞,通入N2一段时间,再关闭活塞,称D装置质量m1克; c.逐滴加入BaCl2溶液至不再产生沉淀;关闭分液漏斗,再用针筒打入稀盐酸,至不再产生气体,实验过程中测得锥形瓶中沉淀的数据如下图; 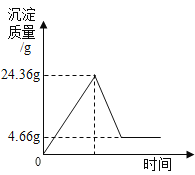 d.打开A中活塞,缓缓通一会儿N2。 e.再称得D装置的质量为m2克; 请你根据题意回答下列问题: (1)24.36g沉淀中含有什么物质(填化学式)_____,针筒注入稀盐酸产生气体的方程式:_____。 (2)求原混合液中K2SO4的质量分数_____。 (3)小明略加思考后说,通过D装置的质量变化可以求出混合溶液中K2CO3的质量分数,结果_____(填“偏大”、“不变”或“偏小”),理由_____。 |
|




