哈尔滨市高一化学2018年上半年月考测验带答案与解析
| 1. 选择题 | 详细信息 |
|
下列实验描述,符合事实的是( ) A. 金属钠暴露在空气中,表面变暗,生成黄色固体氧化钠 B. 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热产生白色固体 C. 用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热 D. 用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 |
|
| 2. 选择题 | 详细信息 |
|
下列关于铁与水蒸气反应的说法中不正确的是( ) A. 反应中有氢气产生 B. 此反应需在加热条件下才能发生 C. 生成的铁的化合物中铁全部呈+3价 D. 该反应中水作氧化剂 |
|
| 3. 选择题 | 详细信息 |
|
在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后 A. 天平保持平衡 B. 左高右低 C. 左低右高 D. 无法确定 |
|
| 4. 选择题 | 详细信息 |
|
下列关于Na2O2的叙述中正确的是 A. Na2O2是淡黄色固体,久置于空气中变成Na2O B. Na2O2与水的反应中,Na2O2只作氧化剂 C. Na2O2属于碱性氧化物 D. Na2O2与CO2或H2O反应,1 mol Na2O2参加反应,转移1 mol电子 |
|
| 5. 选择题 | 详细信息 |
|
把16 g甲烷(CH4)在64 g氧气中完全燃烧后的产物通入足量的过氧化钠后,过氧化钠增加的质量为 A. 48 g B. 16 g C. 80 g D. 32 g |
|
| 6. 选择题 | 详细信息 |
|
有两份质量相同的碳酸氢钠固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积比为( ) A. 2∶1 B. 1∶1 C. 1∶2 D. 4∶1 |
|
| 7. 选择题 | 详细信息 |
|
下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的化合物是 ①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2 CO3 A.③④ B.①②③⑤ C.①③④ D.全部 |
|
| 8. 选择题 | 详细信息 |
|
下列各组离子,在某透明溶液中能大量共存的是( ) A. Fe3+ H+ SO32- Na+ B. AlO2— Na+ H+ SO42- C. NO3— Cu2+ SO42- Cl- D. AlO2— Na+ SO42- HCO3- |
|
| 9. 选择题 | 详细信息 |
|
有Fe2+﹑NO3-﹑NH4+﹑Fe3+、H+- H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( ) A. 若有1mol NO3-参加还原反应,则转移8mole- B. 还原产物为NH4+ C. 氧化剂与还原剂的物质的量之比为8:1 D. 该反应中Fe2+被氧化 |
|
| 10. 选择题 | 详细信息 |
|
有以下物质 ① NaCl溶液 ② 熔融的MgCl2 ③ CuSO4·5H2O固体 ④ NaOH 固体 ⑤ 金属铜 ⑥ 蔗糖。有关它们的说法正确的是 A. 属于非电解质的有①⑤⑥ B. 属于电解质有①②③④ C. 不能导电的有③④⑥ D. 属于混合物的有①②③⑥ |
|
| 11. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是( ) A. CO2通入NaAlO2溶液中:AlO2—+CO2+H2O===Al(OH)3↓+CO32- B. Al2O3与过量氨水:Al2O3+6NH3·H2O===2Al3++6NH4+ C. 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-===Al(OH)3↓ D. 向AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+ |
|
| 12. 选择题 | 详细信息 |
|
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子的物质的量之比变为1∶2∶4,则参加反应的铁粉与原溶液中Fe3+的物质的量之比为( ) A. 2∶1 B. 1∶2 C. 1∶3 D. 1∶4 |
|
| 13. 选择题 | 详细信息 |
|
对于某些离子的检验及结论一定正确的是 A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- C. 加稀硝酸酸化后,溶液中无明显变化,再加入AgNO3溶液,生成白色沉淀,能确定有Cl-存在 D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
|
| 14. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A. 1 mol氩气在标准状况下的体积约为11.2 L B. 20 ℃、10 MPa状态下,32 g O2和O3的混合气体所含原子数为2.5NA C. 标准状况下,11.2 L H2CO3含有的原子数为3NA D. 常温常压下,44 g CO2含有的原子数为3NA |
|
| 15. 选择题 | 详细信息 | ||||||||||||
下列实验与对应示意图的关系正确的是( )
|
|||||||||||||
| 16. 选择题 | 详细信息 |
|
下列有关含铁物质的叙述正确的是( ) A. 向FeCl2溶液中加入NaOH溶液生成红褐色沉淀 B. Fe3+与KSCN溶液反应产生红色沉淀 C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 D. 除去FeCl3溶液中的FeCl2杂质可以向溶液中加入过量铁粉 |
|
| 17. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法正确的是 A. 2g氢气所含原子数目为NA B. 含有NA个原子的氢气在标准状况下的体积约为22.4 L C. 1 mol·L-1 CaCl2溶液中所含Ca2+的数目为NA D. 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA |
|
| 18. 选择题 | 详细信息 |
|
下列关于碳酸钠和碳酸氢钠的说法中,正确的是( ) A. 二者在水中的溶解度不同,Na2CO3<NaHCO3 B. 相同浓度的水溶液的碱性不同,Na2CO3>NaHCO3 C. 向等浓度的二者的溶液中滴加相同浓度的盐酸,开始反应时放出气泡的速率不同,Na2CO3大于NaHCO3 D. 二者在一定的条件下不能相互转化 |
|
| 19. 选择题 | 详细信息 |
|
现有三组物质的分离:①含有水份的植物油中除去水份②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分。分离以上各混合液的正确方法依次是( ) A. 萃取、分液、蒸馏 B. 分液、蒸馏、萃取 C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液 |
|
| 20. 选择题 | 详细信息 |
|
将适量的过氧化钠分别投入下列溶液中,有气体放出且溶液质量减轻的是( ) A. 稀硫酸溶液 B. 氯化铁溶液 C. 碳酸氢钠溶液 D. 氯化钠溶液 |
|
| 21. 选择题 | 详细信息 |
|
下列叙述错误的是( ) A. 丁达尔效应可以用来鉴别胶体和溶液 B. 在水溶液中 NaHSO4 的电离:NaHSO4=Na++ HSO4- C. 配置 FeSO4溶液时,需加入少量铁粉防止 Fe2+被氧化 D. 碳酸氢钠在医疗上可用于治疗胃酸过多 |
|
| 22. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 过氧化钠加入水中:2O22-+2H2O== 4OH-+O2↑ B. 碳酸氢钠溶液加入盐酸:CO32-+2H+==CO2↑+H2O C. 氢氧化铜中加入盐酸:OH-+H+==H2O D. 四氧化三铁跟稀硫酸反应:Fe3O4+8H+==Fe2++2Fe3+ +4H2O |
|
| 23. 选择题 | 详细信息 |
|
高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式为Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O(未配平)下列有关说法不正确的是( ) A. 由上述反应可知,Fe(OH)3的氧化性强于FeO42- B. 高铁酸钾中铁显+6价 C. 上述反应中氧化剂和还原剂的物质的量之比为3∶2 D. K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+与水反应形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
|
| 24. 推断题 | 详细信息 |
|
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体,而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题: (1)写出A、B、C、D、E、F的化学式: A ______, B ______, C _____, D ____, E _____, F _____; (2)写出F和H反应的化学方程式_________________________________________; (3)写出下列反应的离子方程式: ① D+盐酸 _______________________________________________________; ② B+水 _________________________________________________________。 |
|
| 25. 实验题 | 详细信息 |
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)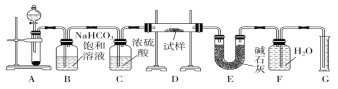 回答下列问题: (1)实验前必须检查装置的气密性。仪器连接好后,在________中加适量的水,关闭A中分液漏斗阀门后微热试管,若看到________,说明装置气密性好。 (2)装置A中液体试剂选用盐酸而不是硫酸,理由是__________________________________________。 (3)装置B的作用是___________;装置C的作用是______________;装置E中碱石灰的作用是__________________。 (4)装置D中发生反应生成气体的化学方程式是_____________________________________________。 (5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_________。 |
|
| 26. 实验题 | 详细信息 |
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。 填写下列空白: (1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是___________________________。 (2)实验开始时应先将活塞a________(填“打开”或“关闭”)。 (3)简述生成Fe(OH)2的操作过程:________________________。 (4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为__________________。 (5)下图中________能较长时间看到Fe(OH)2白色沉淀。  |
|
| 27. 计算题 | 详细信息 |
将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答: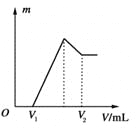 (1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。 (2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。 (3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。 |
|
最近更新