攸县第三中学附答案与解析
| 1. 选择题 | 详细信息 |
最近英国研究人员创造了一种由18个碳原子构成的环碳(cyclocarbon)分子(如图)。下列有关说法错误的是 A.与石墨互为同素异形体 B.是一种新型共价化合物 C.在加热条件下能与浓硝酸反应 D.分子中碳原子均达8电子稳定结构 |
|
| 2. 选择题 | 详细信息 |
|
500℃时向恒容密闭容器中充入1molNO2(g)发生如下反应:2NO2(g) A.气体颜色最终比原平衡时要深 B.NO2的转化率增大 C.平衡向正反应方向移动 D.平衡常数K增大 |
|
| 3. 选择题 | 详细信息 |
利用如图所示装置模拟电解原理在工业生产中的应用 。 下列说法正确的是( ) A.氯碱工业中,X 电极上的反应式是4OH-- 4e-= 2H2O+O2↑ B.电解精炼铜时,Z溶液中的Cu2+ 浓度不变 C.在铁片上镀铜时,Y是纯铜 D.制取金属钠时,Z是熔融的氯化钠 |
|
| 4. 选择题 | 详细信息 |
|
下列化学反应的离子方程式不正确的是( ) A.向饱和Ba(NO3)2溶液中滴加过量NaHCO3溶液生成白色沉淀:Ba2++2HCO B.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH C.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O D.稀硝酸中加入过量的铁屑:3Fe+8H++2NO |
|
| 5. 选择题 | 详细信息 |
有关下列四组实验描述不正确的是 A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl B. 利用装置乙可证明非金属性强弱:Cl>C>Si C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中 D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成 |
|
| 6. 选择题 | 详细信息 |
|
下列热化学方程式或说法正确的是( ) A.甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ•mol-1 B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) C.同温同压下,反应H2+Cl2=2HCl在光照和点燃条件下分别发生反应,两者的反应热相同 D.已知中和热为57.3kJ•mol-1,则稀硫酸与氢氧化钡溶液反应的热化学方程式为2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJ•mol-1 |
|
| 7. 选择题 | 详细信息 |
|
氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为: 第一步I2(g)→2I(g)(快反应) 第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应) 第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应) 实验表明,含碘时N2O分解速率方程v=k•c(N2O)•[c(I2)]0.5(k为速率常数)。下列表述正确的是( ) A.N2O分解反应中,k(含碘)>k(无碘) B.第一步对总反应速率起决定作用 C.第二步活化能比第三步小 D.I2浓度与N2O分解速率无关 |
|
| 8. 选择题 | 详细信息 |
|
实验室可用米乙酮间接电氧化法合成苯甲酸,其原理如图所示,下列说法错误的是( ) (提示碘单质与碱类似氯气和碱的反应)  A.a电极是惰性电极 B.膜X为阴离子交换膜 C.接通电源后,a电极附近溶液会变黄 D.合成苯甲酸的总反应为:   +CHI3+4H+ +CHI3+4H+ |
|
| 9. 选择题 | 详细信息 |
不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是 A. 由①、②可知, pH越大,+2价铁越易被氧化 B. 由②、③推测,若pH>7,+2价铁更难被氧化 C. 由①、③推测,FeCl2被O2氧化的反应为放热反应 D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h) |
|
| 10. 选择题 | 详细信息 |
某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示,下列说法正确的是 ( ) A.实验开始时,先点燃酒精灯,后打开活塞K B.b、c、f中试剂依次为氢氧化钠溶液、浓硫酸、银氨溶液 C.a中所发生反应的离子方程式是CaCO3+2H+=CO2↑+Ca2++H2O D.装置e的作用是收集一氧化碳气体 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||
一定温度下,在5L的恒容密闭容器中发生反应N2(g)+3H2(g)
下列说法正确的是( ) |
|||||||||||||||||||||
| 12. 选择题 | 详细信息 |
从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图,则下列说法正确的是 A.试剂a是铁、试剂b是稀硫酸 B.试剂c是氯气,相应的反应为:2Fe2++Cl2=2Cl-+2Fe3+ C.操作I、操作Ⅱ、操作Ⅲ所用仪器相同 D.用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
探究酸性KMnO4与H2C2O4溶液反应速率的影响因素,有关实验数据如下表所示:
下列说法不正确的是 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14. 选择题 | 详细信息 |
次磷酸钴[Co(H2PO2)2]广泛应用于化学电镀,工业上利用电渗析法制取次磷酸钴的原理图如图所示。 已知:①该装置的电极材料分别为金属钴和不锈钢。 ②Co(H2PO2)2溶液在强碱性条件下通过自身催化发生氧化还原反应,实现化学镀钴。 下列说法中错误的是( ) A.膜Ⅱ阳离子交换膜、膜Ⅲ为阴离子交换膜 B.M电极反应为Co-2e-+2H2PO C.a为电源的正极 D.Co(H2PO2)2溶液化学镀钴过程中反应可能为Co2++H2PO |
|
| 15. 选择题 | 详细信息 |
合成氨反应 下列说法错误的是 A.该合成氨反应的△H=+46 kJ/mol B.活化能最大的一步反应的方程式为Nad+Had=NHad C.升高温度、增大压强均能提高原料的平衡转化率 D.加入催化剂能降低反应活化能,加快正反应速率 |
|
| 16. 实验题 | 详细信息 |
某学习小组设计实验探究NO与铜粉的反应,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2。 (1)实验开始前必须通一段时间N2,如果不通N2,对实验有何影响___。 (2)装置B中NaOH溶液的作用是__。 (3)若装置D中有黑色固体生成,则发生反应的化学方程式是___。 (4)利用NO可制得NH4NO3产品,流程如图:  ①装置I中,酸性条件下NO被Ce4+氧化的产物主要是NO ②已知进入装置Ⅲ溶液中的NO |
|
| 17. | 详细信息 |
PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。 已知: ⅰ.PbCl2微溶于水 ⅱ.PbCl2(s)+2Cl-(aq) (1)浸取过程中MnO2与PbS发生反应的离子反应方程式为__。 (2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__。 (3)调pH的目的是__。 (4)沉降池中获得PbCl2采取的两种措施是__。(根据平衡的观点) (5)通过电解酸性废液可重新获得MnO2,装置示意图如图,获得MnO2的电极反应式为__。  |
|
| 18. 实验题 | 详细信息 | |||||||||||||
|
某小组探究Na2SO3溶液和KIO3溶液的反应。 实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(ts)后,溶液突然变蓝。 查阅资料知:IO (1)针对ts前溶液未变蓝,小组做出如下假设: i.ts前未生成I2,是由于反应的活化能__(填“大”或“小”),反应速率慢导致的。 ii.ts前生成了I2,但由于存在Na2SO3,Na2SO3将生成的I2还原。 (2)下述实验证实了假设ii合理。 实验II:向实验I的蓝色溶液中加入__,蓝色迅速消失,后再次变蓝。 (3)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如图。 实验III:K闭合后,电流表的指针偏转情况记录如表:
①K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,生成白色沉淀。 |
||||||||||||||
| 19. | 详细信息 |
|
CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2的综合利用是解决温室问题的有效途径。 (1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下: CH3OH(g)+ H2(g)+ H2O(g)=H2O(l) ΔH3=ckJ·mol-1 则CO2(g)+3H2(g) (2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)  回答下列问题: ①压强p1、p2、p3的大小关系是__;Ka、Kb、Kc为a、b、c三点对应的平衡常数,则其大小关系是__。 ②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__(保留三位有效数字),该反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 (3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)  (4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为___。其中铅蓄电池的负极反应___。  |
|
| 20. | 详细信息 |
辣椒素是辣椒的活性成分,可以预防心脏病,也能缓解肌肉关节疼痛。辣椒素中酯类化合物的结构为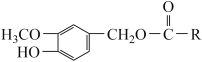 (R为烃基)其中一种辣椒素酯类化合物J的合成路线如图所示。已知: (R为烃基)其中一种辣椒素酯类化合物J的合成路线如图所示。已知: ①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰; ②化合物J的分子式为C15H22O4; ③R1CHO+R2CH2CHO (1)G所含官能团的名称为___。 (2)由A和B生成C的化学方程式为___。 (3)由C生成D的反应类型___。 (4)D的化名称为___。 (5)J的结构简式是___。 (6)G的同分异构体中,苯环上的一氯代物只有一种且其中核磁共振氢谱显示2组峰的是___。(写结构简式) (7)H生成I的化学方程式___。 |
|





