太原市高二化学上册月考试卷免费试卷完整版
| 1. 选择题 | 详细信息 |
|
下列表示电离或水解方程式正确的是( ) A.H2S=2H++S2- B.KHCO3=K++H++CO32- C.HCO3-+H2O D.HClO=H++ClO- |
|
| 2. 选择题 | 详细信息 |
|
室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液 ②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( ) A.加入少量H2O B.加入少量NaOH固体 C.通入少量HCl气体 D.升高温度 |
|
| 3. 选择题 | 详细信息 |
某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是 A. 该原电池的正极反应是Cu2++2e-===Cu B. 甲烧杯中溶液的血红色逐渐变浅 C. 盐桥中的SO42-流向甲烧杯 D. Cu电极质量减少,Pt电极质量增加 |
|
| 4. 选择题 | 详细信息 |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( ) A.升高温度,可能引起由c向b的变化 B.该温度下,水的离子积常数为1.0×10-13 C.该温度下,加入FeCl3可能引起由b向a的变化 D.该温度下,稀释溶液可能引起由c向d的变化 |
|
| 5. 选择题 | 详细信息 | |||||||||||||||
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是
|
||||||||||||||||
| 6. 选择题 | 详细信息 |
|
由硫酸钾、硫酸铝和硫酸组成的混合溶液,pH=1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)=( ) A.0.15mol•L-1 B.0.2mol•L-1 C.0.3mol•L-1 D.0.4mol•L-1 |
|
| 7. 选择题 | 详细信息 | |||||||||||||||||||||||||
如下图所示,下列关于实验现象的描述正确的是( )
|
||||||||||||||||||||||||||
| 8. 选择题 | 详细信息 |
|
下列有关电解质溶液的说法正确的是( ) A.向0.1mol/L的CH3COOH溶液中加少量水,溶液中  减小 减小B.将CH3COONa溶液从20℃升温至30℃,溶液中 C.向盐酸中加入氨水至中性,溶液中 D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.常温下,向pH为2的盐酸中加入等体积的pH=12的氨水恰好完全中和 B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 C.0.2 mol•L-1与0.1 mol•L-1醋酸中c(H+)之比为2:1 D.pH=1的溶液中NH4+、Cl-、Cu2+、SO42-一定能大量共存 |
|
| 10. 选择题 | 详细信息 |
常温下,Ksp(CaSO4)=9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是( ) A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 B.向d点溶液中加入适量CaCl2固体可以变到c点 C.a点对应的Ksp不等于c点对应的Ksp D.b点将有沉淀生成,平衡后溶液中c(SO42-)=3×10-3mol/L |
|
| 11. 选择题 | 详细信息 |
|
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。高铁电池的总反应为:3Zn+2K2FeO4+8H2O A.放电时正极反应为:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH- B.充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH- C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 D.标有“+”的接线柱充电时作阳极,放电时作正极 |
|
| 12. 选择题 | 详细信息 |
|
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( ) A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y |
|
| 13. 选择题 | 详细信息 |
|
2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。少年时代,他就对化学产生了浓厚的兴趣。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是( ) A.金属腐蚀就是金属失去电子被还原的过程 B.将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 C.由原电池原理知所有的合金都比纯金属更易被腐蚀 D.铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-═Fe3+,从而形成铁锈,但此过程铜不被腐蚀 |
|
| 14. 选择题 | 详细信息 |
|
下列叙述中不正确的是( ) A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 D.反应2A(g)+B(g)=3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 |
|
| 15. 选择题 | 详细信息 |
常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-) B. 水的电离程度:b=c>a C. 溶液中离子总物质的量:b>c>a D. 溶液中离子总浓度:a>b>c |
|
| 16. 选择题 | 详细信息 |
微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图2为其工作原理,图1为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是 A. M为电源负极,有机物被氧化 B. 电池工作时,N极附近溶液pH增大 C. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移 D. Cr2O72-离子浓度较大时,可能会造成还原菌失活 |
|
| 17. 选择题 | 详细信息 |
|
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( ) ①热纯碱溶液的洗涤油污能力强; ②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒; ③溶洞、珊瑚的形成; ④碳酸钡不能做“钡餐”而硫酸钡则能; ⑤泡沫灭火器灭火的原理。 A.②③④ B.①②③ C.③④⑤ D.①②③④⑤ |
|
| 18. 选择题 | 详细信息 |
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是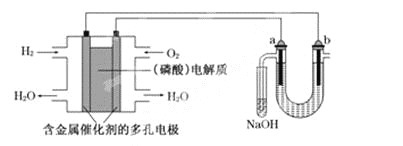 A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH- B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2 |
|
| 19. 选择题 | 详细信息 |
|
现有两正盐的稀溶液,分别是amol/LNaX溶液和bmol/LNaY溶液。下列说法不正确的是 A. 若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY) B. 若a>b,测得c(X-)=c(Y-),可推出酸性HX>HY C. a=b,且pH(NaX)>pH(NaY),则相同浓度时,酸性HX<HY D. a=b,并测得a= c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸 |
|
| 20. 选择题 | 详细信息 |
按如图所示装置进行下列不同的操作, 其中不正确的是 A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 B.只接通K1,一段时间后,U形管中出现白色沉淀 C.只接通K2,U形管左、右两端液面均下降 D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |
|
| 21. 解答题 | 详细信息 |
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则: ①Y电极上的电极反应式为___;在X极附近观察到的实验现象是___; ②电解总反应的离子方程式:____。 (2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则 ①X电极的材料是___;电极反应式是___。 ②Y电极的材料是___;电极反应式是___。 (说明:杂质发生的电极反应不必写出) |
|
| 22. 综合题 | 详细信息 |
|
运用溶液中离子平衡的相关知识,解决下列问题。 (1)含酚酞的0.01mol•L-1CH3COONa溶液显浅红色的原因为___(用离子方程式和必要文字解释)。 (2)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的某氨水溶液,滴定曲线如图所示。  ①d点所示的溶液中离子浓度由大到小的顺序依次为___。 ②b点所示的溶液中c(NH3•H2O)-c(NH4+)=___(用溶液中的其它离子浓度表示)。 ③pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为___。 (3)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。 ①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为___mol/L。 ②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液= |
|
| 23. 综合题 | 详细信息 | ||||||||||||||||||||
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
|
|||||||||||||||||||||
| 24. 综合题 | 详细信息 | |||||||||
(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
|
||||||||||
| 25. 综合题 | 详细信息 |
如图设计的串联电池装置,R为变阻器,以调节电路电流。 (1)写出b、c电极的电极反应式:b___,c___; (2)写出f电极的电极反应式___,向此电极区域滴入酚酞的现象为:___;该电极区域水的电离平衡被___(填“促进”、“抑制”或“无影响”)。 (3)闭合K一段时间后,丙装置的电解质溶液pH___(填“变大”、“变小”或“不变”),原因是___。 (4)电解一段时间后丙装置析出芒硝(Na2SO4•10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入___gH2O就可以将析出的沉淀溶解并恢复到原有浓度。 (5)有一硝酸盐晶体,其化学式为M(NO3)x•yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则 ①金属M的相对原子质量为___; ②电解后,生成气体体积=___(标准状况下)溶液的pH=___(电解过程中溶液体积变化忽略不计)。要求写出计算过程。 |
|





