绵阳南山中学实验学校高一化学下册月考试卷刷题训练
| 1. 选择题 | 详细信息 |
|
对于硫酸和硝酸的叙述中,下列叙述不正确的是 A.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性 B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 C.王水是浓盐酸和浓硝酸按 3:1 混合,具有很强的腐蚀性,可以腐蚀金和铂 D.硫酸和硝酸都是重要的化工原料 |
|
| 2. 选择题 | 详细信息 |
|
下列化学用语或分子结构模型表示正确的是 A.中子数为146、质子数为92的铀(U)原子 B.四氯甲烷的球棍模型: C.乙烷的结构简式:CH3CH3 D.HClO的电子式: |
|
| 3. 选择题 | 详细信息 |
能用如图装置进行喷泉实验,最终溶液几乎充满烧瓶的一组气体是 A.HCl和CO2 B.NH3和CO C.O2和NO2体积比为1:1 D.Cl2和NO |
|
| 4. 选择题 | 详细信息 |
|
下列关于碱金属和卤素的说法中,错误的是 A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强 C.钾与水比钠与水的反应更剧烈 D.碱金属和卤素元素单质的熔沸点,随原子序数的增大而升高 |
|
| 5. 选择题 | 详细信息 |
|
下列分子式代表的可能是混合物的是 A.C2H5Cl B.C3H8 C.CF2Cl2 D.C3H7Cl |
|
| 6. 选择题 | 详细信息 |
|
反应A+3B2 ①v(A)=0.15 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1 该反应进行的快慢顺序为: ( ) A.②﹥④﹥③﹥① B.④﹥③﹥②﹥① C.④﹥③=②﹥① D.②﹥③=④﹥① |
|
| 7. 选择题 | 详细信息 |
|
A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为 A.A>B>C B.A>C>B C.C>B>A D.B>C>A |
|
| 8. 选择题 | 详细信息 |
|
下列反应既属于氧化还原反应,又是吸热反应的是: A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2的反应 C.甲烷在空气中燃烧的反应 D.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
|
| 9. 选择题 | 详细信息 |
|
在常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,其中消耗氧气最多的是 A.CH4 B.C2H6 C.C3H8 D.C4H10 |
|
| 10. 选择题 | 详细信息 |
|
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y是同周期金属性最强的元素,Z的单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是 A.原子半径大小顺序:r(W)>r(Y)>r(X) B.非金属性强弱顺序:X>W>Z C.最高价氧化物对应水化物的酸性:Z>W D.化合物Y2X、ZX2、WX3中化学键类型相同 |
|
| 11. 选择题 | 详细信息 |
|
一定温度下的某容积不变的密闭容器中,建立下列化学平衡 C(s)+H2O(g) A.体系的压强不再发生变化 B.气体密度不再改变 C.生成n mol CO的同时生成n mol H2 D.1 mol H–H键断裂的同时断裂2 molH–O键 |
|
| 12. 选择题 | 详细信息 | ||||||||||
在常温常压下断裂1 mol指定共价键时吸收的能量如下表:
|
|||||||||||
| 13. 选择题 | 详细信息 |
|
下列离子方程式中,正确的是 A.将氨气通入醋酸中:NH3+H+ === NH B.在NH4Cl溶液中滴入氢氧化钠溶液并加热:NH+OH-NH3↑+H2O C.将少量铜屑放入稀硝酸中:Cu+4H++NO===Cu2++NO↑+2H2O D.将稀硝酸滴在铁片上:Fe+2H+=== Fe2++H2↑ |
|
| 14. 选择题 | 详细信息 | ||||||||||||||||||||
设计一个原电池来实现反应:2Fe3++Cu==2Fe2++Cu2+,下列各选项中,电极和电解质溶液选择均正确的是
|
|||||||||||||||||||||
| 15. 选择题 | 详细信息 |
氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是 A.a极为负极,b极为正极 B.负极发生氧化反应 C.正极的电极反应为O2+2H2O+2e﹣═4OH﹣ D.负极的电极反应为H2+2OH﹣﹣2e﹣═2H2O |
|
| 16. 选择题 | 详细信息 |
|
在100mL混合液中,HNO3和H2SO4物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92gCu粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( ) A.0.15 mol/L B.0.45 mol/L C.0.35 mol/L D.0.225 mol/L |
|
| 17. 综合题 | 详细信息 | ||||||||||||
现有部分短周期元素的性质或原子结构如表:
|
|||||||||||||
| 18. 综合题 | 详细信息 |
如图是:600℃ 时,在2L密闭容器里A、B、C三种气体在密闭容器中反应时浓度的变化,其中A为有色气体,B、C是无色气体。请从图中分析并填空: (1)该反应的化学反应方程式为_____ (2)反应达到平衡状态时,反应物的转化率为_____ (3)当反应进行到第_____min,该反应达到平衡。 (4)反应从开始至2分钟末,B的物质的量_____,用B的浓度变化表示的平均反应速率为v(B)=_ (5)下列描述能表示反应达平衡状态的是_____(填选项)。 a.容器中A与B的物质的量相等 b.容器内气体的颜色不再改变 c.各物质的浓度保持不变 |
|
| 19. 实验题 | 详细信息 |
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO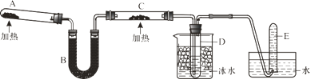 回答下列问题: (1)A中发生反应的化学方程式是_____。 (2)B中加入的物质是_____。 (3)实验时在C中观察到的现象是_____,该反应中氨的作用是_____(填氧化剂或还原剂)。 (4)检验实验后试管D中物质的方法和现象是_____。 |
|
| 20. 计算题 | 详细信息 |
|
19.2g铜投入100mL 14mol/L浓HNO3 溶液中,充分反应后无固体剩余,收集到标准状况下气体8.96L。计算: (1)所得气体的质量_____ (2)向反应后的溶液中加入多少毫升10mol/L NaOH溶液才能使Cu2+完全沉淀?____ |
|



