зҰҸе·һеёӮж— зәёиҜ•еҚ·
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”дёӯпјҢеұһдәҺеҗёзғӯеҸҚеә”зҡ„жҳҜпјҲ пјү AпјҺжҙ»жіјйҮ‘еұһи·ҹй…ёеҸҚеә” BпјҺеҲ¶йҖ ж°ҙз…Өж°” CпјҺй…ёзўұдёӯе’ҢеҸҚеә” DпјҺй•ҒжқЎзҮғзғ§ |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—з”өжұ еұһдәҺдәҢж¬Ўз”өжұ зҡ„жҳҜ(гҖҖгҖҖ) A.银й”ҢзәҪжүЈз”өжұ B.ж°ўж°§зҮғж–ҷз”өжұ C.й“…и“„з”өжұ D.й”Ңй”°е№Із”өжұ |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҳеҢ–иҝҮзЁӢдёӯпјҢО”Sпјң0зҡ„жҳҜпјҲгҖҖгҖҖпјү A.ж°ҜеҢ–й’ жә¶дәҺж°ҙдёӯ B.CaCO3пјҲsпјүеҲҶи§ЈдёәCaOпјҲsпјүе’ҢCO2пјҲgпјү C.е№ІеҶ°зҡ„еҚҮеҚҺ D.NH3пјҲgпјүе’ҢHClпјҲgпјүеҸҚеә”з”ҹжҲҗNH4Cl |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ«NaOH 20.0gзҡ„зЁҖжә¶ж¶ІдёҺи¶ійҮҸзЁҖзӣҗй…ёеҸҚеә”пјҢж”ҫеҮә28.7 kJзҡ„зғӯйҮҸпјҢиЎЁзӨәиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)в–іH= +28.7 kJВ·mol-1 B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)в–іH= _28.7 kJВ·mol-1 C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)в–іH=+57.4 kJВ·mol-1 D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)в–іH= _57.4 kJВ·mol-1 |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ2A(g)пјӢB(s) A.П…(A)пјқ 0.5 molпјҸ(LВ·пҪ“) B.П…(B)пјқ 0.3 molпјҸ(LВ·пҪ“) C.П…(C)пјқ 0.8 molпјҸ(LВ·пҪ“) D.П…(D)пјқ 1 molпјҸ(LВ·пҪ“) |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ2LеҜҶй—ӯе®№еҷЁеҶ…пјҢжҹҗж°”дҪ“еҸҚеә”зү©еңЁ2sеҶ…з”ұ8molеҸҳдёә7.2molпјҢеҲҷз”ЁиҜҘж°”дҪ“иЎЁзӨәиҜҘеҸҚеә”зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮдёә A.0.4 molВ·LвҲ’1В·sвҲ’1 B.0.3 molВ·LвҲ’1В·sвҲ’1 C.0.2 molВ·LвҲ’1В·sвҲ’1 D.0.1 molВ·LвҲ’1В·sвҲ’1 |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжё©еәҰдёӢпјҢеҸҜйҖҶеҸҚеә”A(g)пјӢ3B(g) A.з”ҹжҲҗCзҡ„йҖҹзҺҮзӯүдәҺж¶ҲиҖ—Aзҡ„йҖҹзҺҮзҡ„2еҖҚ B.еҚ•дҪҚж—¶й—ҙз”ҹжҲҗn mol AпјҢеҗҢж—¶з”ҹжҲҗ3n mol B C.AгҖҒBгҖҒCзҡ„жө“еәҰдёҚеҶҚеҸҳеҢ– D.AгҖҒBгҖҒCзҡ„еҲҶеӯҗж•°жҜ”дёә1вҲ¶3вҲ¶2 |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„иҜҙжі•пјҢжӯЈзЎ®зҡ„жҳҜ( ) A.з”Ёй“ҒзүҮе’ҢзЁҖзЎ«й…ёеҸҚеә”еҲ¶еҸ–ж°ўж°”ж—¶пјҢж”№з”Ёй“ҒзүҮе’Ңжө“зЎ«й…ёеҸҜд»ҘеҠ еҝ«дә§з”ҹж°ўж°”зҡ„йҖҹзҺҮ B.100mL C.дәҢж°§еҢ–зЎ«зҡ„еӮ¬еҢ–ж°§еҢ–жҳҜдёҖдёӘж”ҫзғӯеҸҚеә”пјҢжүҖд»ҘеҚҮй«ҳжё©еәҰпјҢеҸҚеә”еҮҸж…ў D.жұҪиҪҰе°ҫж°”дёӯзҡ„ |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ298KдёӢеҸҚеә”2Al2O3(s)+3C(s)=4Al(s)+3CO2(g) О”H=+2171kJВ·mol-1 О”S=+635.5JВ·mol-1В·K-1пјҢеҲҷжӯӨеҸҚеә” A.й«ҳжё©дёӢеҸҜиҮӘеҸ‘иҝӣиЎҢ B.д»»дҪ•жқЎд»¶дёӢйғҪеҸҜиҮӘеҸ‘иҝӣиЎҢ C.д»»дҪ•жқЎд»¶дёӢйғҪдёҚеҸҜиҮӘеҸ‘иҝӣиЎҢ D.дҪҺжё©дёӢеҸҜиҮӘеҸ‘иҝӣиЎҢ |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„еӣҫдёӯпјҢиЎЁзӨәжӯЈеҸҚеә”жҳҜеҗёзғӯеҸҚеә”зҡ„еӣҫжҳҜ( ) A.  B. B. C.  D. D.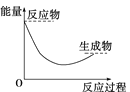 |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жҲ–иЎЁзӨәж–№жі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү A.з”ұCпјҲзҹіеўЁпјүпјқ CпјҲйҮ‘еҲҡзҹіпјүпјӣв–іHпјқпјӢ1.90 kJ/molеҸҜзҹҘпјҢйҮ‘еҲҡзҹіжҜ”зҹіеўЁзЁіе®ҡ B.зӯүзү©иҙЁзҡ„йҮҸзҡ„еӣәдҪ“зЎ«е’ҢзЎ«и’ёж°”еҲҶеҲ«е®Ңе…ЁзҮғзғ§пјҢеҗҺиҖ…ж”ҫеҮәзғӯйҮҸеӨҡ C.еңЁ101kPaж—¶пјҢ2gж°ўж°”е®Ңе…ЁзҮғзғ§з”ҹжҲҗж¶ІжҖҒж°ҙпјҢж”ҫеҮә285.8kJзғӯйҮҸпјҢж°ўж°”зҮғзғ§зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәдёәпјҡ2H2(g)+O2(g)= 2H2O(l)пјӣв–іHпјқпјҚ285.8kJ/mol D.еңЁзЁҖжә¶ж¶ІдёӯпјҢH+(aq)+ OH-(aq) = H2O(l)пјӣв–іHпјқпјҚ57.3kJ/mol,иӢҘе°Ҷеҗ«0.5molH2SO4зҡ„жө“зЎ«й…ёдёҺеҗ«1molNaOHзҡ„жә¶ж¶Іж··еҗҲпјҢж”ҫеҮәзҡ„зғӯйҮҸзӯүдәҺ57.3kJ |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ійҮ‘еұһи…җиҡҖзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A.з”өеҢ–еӯҰи…җиҡҖжҳҜеңЁеӨ–еҠ з”өжөҒдҪңз”ЁдёӢдёҚзәҜйҮ‘еұһеҸ‘з”ҹеҢ–еӯҰеҸҚеә”иў«жҚҹиҖ—зҡ„иҝҮзЁӢ B.йҮ‘еұһзҡ„з”өеҢ–еӯҰи…җиҡҖе’ҢеҢ–еӯҰи…җиҡҖжң¬иҙЁзӣёеҗҢпјҢдҪҶз”өеҢ–еӯҰи…җиҡҖдјҙжңүз”өжөҒдә§з”ҹ C.й’ўй“Ғи…җиҡҖжңҖжҷ®йҒҚзҡ„жҳҜеҗёж°§и…җиҡҖпјҢиҙҹжһҒеҗёж”¶ж°§ж°”пјҢдә§зү©жңҖз»ҲиҪ¬еҢ–дёәй“Ғй”Ҳ D.й•Җй”Ңзҡ„й“ҒжқҝжҜ”й•Җй”Ўзҡ„й“Ғжқҝжӣҙе®№жҳ“иў«и…җиҡҖ |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дәӢе®һпјҢдёҚиғҪз”ЁеӢ’еӨҸзү№еҲ—еҺҹзҗҶи§ЈйҮҠзҡ„жҳҜ( ) A.еҸҚеә”CO(g)+NO2(g) вҮҢCO2(g)+NO(g) в–іH<0пјҢеҚҮй«ҳжё©еәҰеҸҜдҪҝе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁ B.й’ўй“ҒеңЁжҪ®ж№ҝзҡ„з©әж°”дёӯе®№жҳ“з”ҹй”Ҳ C.ејҖеҗҜе•Ө酒瓶еҗҺпјҢ瓶дёӯ马дёҠжіӣиө·еӨ§йҮҸжіЎжІ« D.SO2еӮ¬еҢ–ж°§еҢ–жҲҗSO3зҡ„еҸҚеә”пјҢеҫҖеҫҖеҠ е…ҘиҝҮйҮҸзҡ„з©әж°” |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
дёӢеҲ—еҗ„е®№еҷЁдёӯзӣӣжңүжө·ж°ҙпјҢй“ҒеңЁе…¶дёӯиў«и…җиҡҖж—¶з”ұеҝ«еҲ°ж…ўзҡ„йЎәеәҸжҳҜпјҲ пјү A.4>2>1>3>5 B.2>1>5>3>4 C.5>4>2>3>1 D.3>5>2>4>1 |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҪ“еҸҜйҖҶеҸҚеә”2SO2(g)+O2(g)=2SO3(g)пјҢиҫҫеҲ°е№іиЎЎеҗҺйҖҡе…Ҙ18O2еҶҚж¬ЎиҫҫеҲ°е№іиЎЎж—¶18OеӯҳеңЁдәҺ( ) A.SO3гҖҒO2дёӯ B.SO2гҖҒSO3дёӯ C.SO2гҖҒO2гҖҒSO3дёӯ D.SO2гҖҒO2дёӯ |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеҸҚеә”A2пјҲgпјүпјӢ2B2пјҲgпјү A.еҚҮй«ҳжё©еәҰ B.еўһеӨ§еҺӢејә C.дҪҝз”ЁеӮ¬еҢ–еүӮ D.еўһеӨ§AB2зҡ„жө“еәҰ |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
(1)ж°ўиғҪзҡ„дјҳзӮ№жҳҜзҮғзғ§зғӯеҖјй«ҳпјҢж— жұЎжҹ“гҖӮзӣ®еүҚе·ҘдёҡеҲ¶ж°ўж°”зҡ„дёҖдёӘйҮҚиҰҒеҸҚеә”дёәCO(g)+H2O(g)=CO2(g)+H2(g)О”HпјҢеҸҚеә”иҝҮзЁӢе’ҢиғҪйҮҸзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҡ в‘ CO(g)+H2O(g)=CO2(g)+H2(g)О”H__0(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖң=вҖқ)пјӣ в‘ЎиҝҮзЁӢв…ЎжҳҜеҠ е…ҘеӮ¬еҢ–еүӮеҗҺзҡ„еҸҚеә”иҝҮзЁӢпјҢеҲҷиҝҮзЁӢв… е’Ңв…Ўзҡ„еҸҚеә”зғӯ__(еЎ«вҖңзӣёзӯүвҖқжҲ–вҖңдёҚзӣёзӯүвҖқ)пјҢеҺҹеӣ жҳҜ__пјӣ в‘ўе·ІзҹҘпјҡH2(g)+ H2O(l)=H2O(g)О”H=+44.0kJВ·mol-1 еҲҷH2(g)зҮғзғ§з”ҹжҲҗH2O(l)зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёә__гҖӮ (2)еңЁдёҖе®ҡжқЎд»¶дёӢпјҢAж°”дҪ“дёҺBж°”дҪ“еҸҚеә”з”ҹжҲҗCж°”дҪ“гҖӮеҸҚеә”иҝҮзЁӢдёӯпјҢеҸҚеә”зү©дёҺз”ҹжҲҗзү©зҡ„жө“еәҰйҡҸж—¶й—ҙеҸҳеҢ–зҡ„жӣІзәҝеҰӮеӣҫжүҖзӨәпјҢеҲҷ  в‘ иҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡ___пјӣ в‘Ўt1sж—¶еҸҚеә”зү©Aзҡ„иҪ¬еҢ–зҺҮдёәпјҡ___пјӣ в‘ў0пҪһt1sеҶ…Aзҡ„еҸҚеә”йҖҹзҺҮдёә(еҒҮи®ҫt1=6)v(A)=___гҖӮ |
|
| 18. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
(1)еңЁдёҖе®ҡдҪ“з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯиҝӣиЎҢеҰӮдёӢеҢ–еӯҰеҸҚеә”пјҡCO2(g)+H2(g)
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ |
|||||||||||||
| 19. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
(1)еҰӮеӣҫжүҖзӨәпјҢе°Ҷй”ҢгҖҒй“ңйҖҡиҝҮеҜјзәҝзӣёиҝһпјҢзҪ®дәҺзЁҖзЎ«й…ёдёӯгҖӮ в‘ й”ҢзүҮдёҠзҡ„зҺ°иұЎжҳҜй”ҢзүҮйҖҗжёҗжә¶и§ЈпјҢз”өжһҒеҸҚеә”дёә___пјӣ в‘Ўз”өжөҒз”ұ___з»ҸеҜјзәҝжөҒеҗ‘___пјҢиҜҙжҳҺ___дёәжӯЈжһҒпјӣ в‘ўеҪ“收йӣҶеҲ°ж°ўж°”4.48L(ж ҮеҶөдёӢ)ж—¶пјҢйҖҡиҝҮеҜјзәҝзҡ„з”өеӯҗдёә___molгҖӮ (2)еңЁ25в„ғж—¶пјҢз”ЁзҹіеўЁз”өжһҒз”өи§Ј2.0L2.5mol/LCuSO4жә¶ж¶Іпјӣ5minеҗҺпјҢеңЁдёҖдёӘзҹіеўЁз”өжһҒдёҠжңү6.4gCuз”ҹжҲҗгҖӮиҜ•еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ ___жһҒеҸ‘з”ҹж°§еҢ–еҸҚеә”пјҢз”өжһҒеҸҚеә”ејҸдёә___пјӣ в‘Ўеҫ—еҲ°O2зҡ„дҪ“з§Ҝ(ж ҮеҮҶзҠ¶еҶө)жҳҜ___LгҖӮ |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
(1)е·ІзҹҘжӢҶејҖ1molH-Hй”®гҖҒ1molI-Iй”®гҖҒ1molH-Iй”®еҲҶеҲ«йңҖиҰҒеҗёж”¶зҡ„иғҪйҮҸдёә436kJгҖҒ151kJгҖҒ299kJгҖӮеҲҷз”ұж°ўж°”е’ҢзўҳеҸҚеә”з”ҹжҲҗ1molHIйңҖиҰҒ___(еЎ«вҖңж”ҫеҮәвҖқжҲ–вҖңеҗёж”¶вҖқ)___ kJзҡ„зғӯйҮҸгҖӮ (2)дёәеҲҶеҲ«йӘҢиҜҒжё©еәҰгҖҒжө“еәҰгҖҒеӮ¬еҢ–еүӮйў—зІ’еӨ§е°ҸеҜ№еҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ规еҫӢпјҢжҹҗеҗҢеӯҰи®ҫи®ЎдәҶеҰӮдёӢ4з»„е®һйӘҢгҖӮ
в‘ дёҠиЎЁдёӯпјҢеҸҚеә”йҖҹзҺҮжңҖеҝ«зҡ„жҳҜ___(еЎ«е®һйӘҢеәҸеҸ·)пјӣ |
|||||||||||||||||||||
- еҶ…и’ҷеҸӨй«ҳдәҢеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2019е№ҙеҗҺеҚҠжңҹпјүеңЁзәҝзӯ”йўҳ
- иҺҶ田第дәҢеҚҒдә”дёӯеӯҰ2019е№ҙй«ҳдәҢдёӢеҚҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•еңЁзәҝеҒҡйўҳ
- еҶ…и’ҷеҸӨе‘је’Ңжө©зү№еёӮ第еҚҒе…ӯдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеӯҰжңҹ第дёҖж¬ЎиҙЁйҮҸжЈҖжөӢеҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲ
- д№ҫе®үеҺҝдёғдёӯ2017е№ҙй«ҳдёҖеҢ–еӯҰдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- е®ңжҳҘеёӮй«ҳдәҢеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ
- 2018-2019е№ҙй«ҳдёҖдёҠеҚҠе№ҙ第дёүж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·пјҲж№–еҚ—зңҒиҢ¶йҷөеҺҝ第дёүдёӯеӯҰпјү
- й«ҳдёҖдёӢеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰдё“йўҳи®ӯз»ғпјҲ2019-2020е№ҙеӣӣе·қзңҒйӣ…е®үеёӮпјү
- 2018-2019е№ҙй«ҳдёҖдёӢеҶҢж•ҷеӯҰиҙЁйҮҸи°ғз ”дёүеҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲеҶ…и’ҷеҸӨеҢ—дә¬е…«дёӯд№Ңе…°еҜҹеёғеҲҶж Ўпјү



