2019-2020年高二上期第二次月考化学题免费试卷(福建省永安市第三中学)
| 1. 选择题 | 详细信息 | ||||||||
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)
|
|||||||||
| 2. 选择题 | 详细信息 |
中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是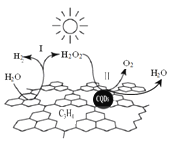 A. C3N4中C的化合价为 -4 B. 反应的两个阶段均为吸热过程 C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂 D. 通过该反应,实现了化学能向太阳能的转化 |
|
| 3. 选择题 | 详细信息 |
已知pOH= -lgc(OH-),在T℃下,水溶液中pH与pOH的关系如图中直线所示。下列说法正确的是 A.T℃下水的离子积为10-14 B.若P点对应的温度为T1,则T1>T C.T℃,pH=3溶液中,由水电离产生的c(H+)一定为1.0×10-10mol·L-1 D.T℃时,pH=4的盐酸与pOH=4氨水等体积混合后溶液pH>6.5 |
|
| 4. 选择题 | 详细信息 | ||||||||||
10 ℃时加热NaHCO3溶液,测得溶液pH发生如下变化:
|
|||||||||||
| 5. 选择题 | 详细信息 |
|
下列事实不涉及盐类水解应用的是 A.明矾、氯化铁晶体常用于净水 B.实验室通常在HCl气氛中加热MgCl2·6H2O制MgCl2 C.草木灰与铵态氮肥不能混合施用 D.实验室用Zn与稀硫酸制H2时,加入几滴CuSO4可加快反应速率 |
|
| 6. 选择题 | 详细信息 |
有关下列电化学装置的说法中正确的是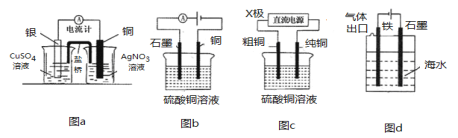 A.图a是原电池装置,可以实现化学能转化为电能 B.图b电解一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度 C.图c中的X极若为负极,则该装置可实现粗铜的精炼 D.图d装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
|
| 7. 选择题 | 详细信息 |
在一容积可变的密闭容器中,充入一定量的H2和I2(g)发生反应:I2(g)+H2(g)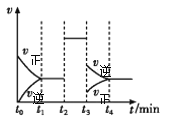 A.t0—t2时段,H2的浓度不变即体系达到平衡 B.t2时,改变的条件只有加入催化剂才能实现 C.在t4所处的平衡体系中,再加入H2,I2(g)的转化率增大 D.HI的体积分数最高的时段是t1—t2 |
|
| 8. 选择题 | 详细信息 |
|
为使Na2S溶液中c(Na+)/c(S2-)的值减小,可加入的物质是 ①盐酸 ②适量的NaOH溶液 ③适量的KOH溶液 ④适量的K2S固体 A.①② B.②③ C.③④ D.①④ |
|
| 9. 选择题 | 详细信息 |
|
25 ℃时,pH=13的Ba(OH)2 Va mL 与pH=2的HCl Vb mL混合,若所得溶液的pH为11,则Va∶Vb为 A.1:9 B.9:1 C.1:10 D.10:1 |
|
| 10. 选择题 | 详细信息 |
|
下列关于能源和作为能源的物质的叙述中,错误的是 A.生物质能来源于植物及其加工产品所贮存的能量 B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 C.物质的化学能可以在不同条件下转化为热能、电能,并为人类所利用 D.煤、石油、天然气均为化石燃料,它们属于可再生能源 |
|
| 11. 选择题 | 详细信息 |
反应A(g)+B(g) = C(g) ΔH,分两步进行:①A(g)+B(g) = X(g)ΔH1 (慢)②X(g) = C(g) ΔH2(快)反应过程中能量变化如下图所示,下列说法正确的是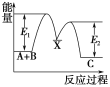 A.ΔH1+ ΔH2=ΔH >0 B.E2表示反应C(g) =X (g)的活化能 C.E1是反应①的反应热 D.整个反应的速率快慢由反应②决定 |
|
| 12. 选择题 | 详细信息 | ||||||||||||||||||||
下列各组分类正确的是
|
|||||||||||||||||||||
| 13. 选择题 | 详细信息 |
|
下列说法正确的是 A.强电解质的导电能力一定比弱电解质强 B.CO2的水溶液导电能力很弱,所以CO2是弱电解质 C.在AlCl3溶液中,水的电离程度一定比纯水更大 D.弱电解质在溶液里达到电离平衡时,弱电解质分子的浓度和离子的浓度相等 |
|
| 14. 选择题 | 详细信息 |
|
下列事实不能用化学平衡移动原理解释的是 A.光照新制的氯水时,溶液的pH逐渐减小 B.在铂铑合金催化下缩短N2和H2合成氨的时间 C.可用浓氨水和氢氧化钠固体快速制取氨气 D.红棕色的NO2,加压后颜色先变深后变浅 |
|
| 15. 选择题 | 详细信息 | ||||||||
25℃时,电离平衡常数如下表,下列说法错误的是
|
|||||||||
| 16. 选择题 | 详细信息 | ||||||||||||||||||||||||
某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响。实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是:2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
|
|||||||||||||||||||||||||
| 17. 选择题 | 详细信息 |
常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是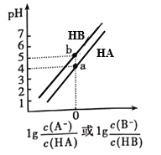 A.等pH的两种酸的浓度:c(HA) < c(HB) B.电离平衡常数:10Ka(HA)= Ka(HB) C.b点溶液:c(B−)=c(HB)>c(Na+)>c(H+)>c(OH−) D.向HB溶液中滴加NaOH溶液至pH=7时:c(B−)> c(HB) |
|
| 18. 填空题 | 详细信息 |
|
现有25℃,0.1mol·L-1的以下溶液:A.NaOH B.NH4Cl C.Al2(SO4)3 D.Na2CO3 E.NaHSO4 F.NaHCO3 (1)A、B、D、F四种溶液的pH由大到小的顺序是_____________。(填编号) (2)常温下,溶液E的pH_______7(填“>”、“<”、“=”),其原因是___________。(用电离方程式表示) (3)泡沫灭火器原料是C与F两溶液,其反应原理的离子方程式为______________。 |
|
| 19. 综合题 | 详细信息 |
|
合理利用和转化PCl5、NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。 (1)已知:P4(s) + 6Cl2(g) = 4PCl3(g) △H1= c kJ•mol-1 P4(s) +10Cl2(g) = 4PCl5(g) △H2= d kJ•mol-1 PCl3、PCl5分子的结构如图,其中实线表示化学键。若断开PCl5分子中1mol P-Cl键,平均消耗x kJ的能量,断开PCl3中1mol P-Cl键消耗1.2x kJ的能量。 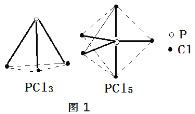 ①写出PCl3与Cl2反应的热化学方程式_______。(热值用c、d表示) ②断开1mol的Cl-Cl键消耗的能量为________。 (2)NOx的排放主要来自于汽车尾气,利用反应:C(s)+2NO(g) 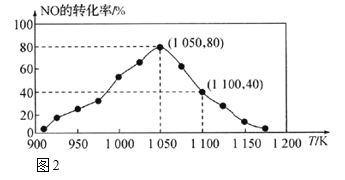 ①由图2可知,反应在温度1050K之前,NO的转化率随温度升高而增大,其原因是_______;在1100K时,CO2的体积分数为___。 ②用物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________。[已知:气体分压P分=气体总压(P总)×气体物质的量分数] (3)反应N2O4(g) 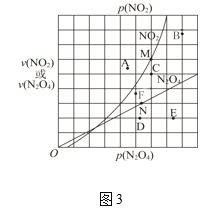 ①在T℃时,图3中M、N点能表示该反应达到平衡状态,理由是________。 ②改变温度,υ(NO2)会由M点变为A、B或C,υ(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,NO2和N2O4相对应的点分别是___、 ___(填字母) (4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图4所示。 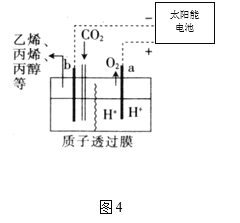 ①a极发生________(填“氧化”或“还原”)反应。 ②电解时,b极上生成乙烯的电极反应为________。 |
|
| 20. 综合题 | 详细信息 |
|
钴、镍与铁是同族元素,它们的单质及化合物的性质有很多相似之处。 (1) 为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如下甲、乙、丙三个实验装置。丙装置中X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。  ①甲池Fe电极反应式为_________。由现象可知三种金属的活动性由强到弱的顺序是__________(填元素符号) 。 ②写出丙装置中反应的离子方程式____________________。 (2)Na2FeO4具有广泛用途,可通过电解法制取得到,工作原理图丁所示。通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。已知: Na2FeO4只在强碱性条件下稳定,易被H2还原。 ①Fe电极反应式为________。 ②电解过程中,须将阴极产生的气体及时排出,其原因是_______________。 ③当阴极产生112mL(标准状况)的气体时,通过阴离子交换膜的离子有_______mol。 |
|
| 21. 综合题 | 详细信息 |
|
水溶液中存在多种平衡。 (1)下列性质中,可以证明醋酸是弱电解质的是_______。 A.0.1mol·L-1醋酸钠溶液呈碱性 B. 醋酸以任意比与水互溶 C. 10mL 1mol·L-1 醋酸恰好与10mL 1mol·L-1 NaOH溶液完全反应 D. 醋酸溶液的导电性比一元强酸溶液弱 (2)已知25℃时,0.1mol·L-1醋酸、0.1mol·L-1HA溶液的pH均为3,NH4A盐溶液呈中性, 则CH3COONH4溶液pH_____7(填“>”、“<”、“=”)。 (3)25℃时0.1mol·L-1 的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。 ①为了验证上述哪种解释正确,继续做如下实验:向0.1mol·L-1 的醋酸溶液中加入少量下列物质中的______(填写编号),然后测定溶液的pH。 A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3 ②若_________(填“甲”或“乙”)的解释正确,溶液的pH应______(填“增大”“减小”或“不变”)。 (4)将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液。 ①溶液中共有______种粒子。 ②其中有两种粒子的物质的量之和一定等于0.010mol,它们是______和______。 ③溶液中n(CH3COO-)+n(OH-)-n(H+)=______mol。 |
|



