高一化学上册单元测试模拟考试练习
| 1. 选择题 | 详细信息 |
|
下列变化中只有通过还原反应才能实现的是( ) A. Fe3+→Fe2+ B.Mn2+→MnO4- C.Cl-→Cl2 D.N2O3→HNO2 |
|
| 2. 选择题 | 详细信息 |
|
下列判断正确的是( ) A.由同一种元素组成的物质一定是纯净物 B.两种元素只能组成一种化合物 C.一种元素在同一种化合物中只能显示一种价态 D.金属元素在化合物中只显示正化合价,而非金属元素在化合物中可以显示正化合价或负化合价 |
|
| 3. 选择题 | 详细信息 |
|
向Ba(OH)2溶液中逐滴加入稀硫酸,溶液导电性的变化合理的图像为 A.  B. B. C. C. D. D. |
|
| 4. 选择题 | 详细信息 |
|
下列关于铁的说法正确的是( ) A.铁粉在空气中燃烧的产物是FeO,铁在纯氧中燃烧生成Fe2O3 B.铁在硫蒸气中燃烧生成Fe2S3 C.纯铁的抗蚀能力非常强,铁在干燥的空气里不易被氧化 D.铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3 |
|
| 5. 选择题 | 详细信息 |
|
下列家庭小实验不能制得溶液的是 ( ) A.  B. B.  C. C.  D. D.  |
|
| 6. 选择题 | 详细信息 |
|
在水溶液中,下列电离方程式正确的是( ) A.NaOH== B.NaOH===Na++H++O2- C.H2SO4 D.NaOH===Na++OH- |
|
| 7. 选择题 | 详细信息 |
|
盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是 ( ) ①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸 A. ①②③ B. ①④⑥ C. ②⑤⑥ D. 全部 |
|
| 8. 选择题 | 详细信息 |
|
在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( ) A. 3 mol B. 2 mol C. |
|
| 9. 选择题 | 详细信息 |
|
已知反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O; ②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列叙述正确的是 A. 反应①中Se是氧化产物,I2是还原产物 B. 反应②中浓H2SO4是氧化剂,SeO2是还原产物 C. 反应①中每有1.0mol I2生成,转移电子数目为4NA D. SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 |
|
| 10. 选择题 | 详细信息 |
|
下列化学反应中,不属于氧化还原反应的是( ) A. Mg+2HCl===MgCl2+H2↑ B. 2NO+O2===2NO2 C. CuO+H2 |
|
| 11. 选择题 | 详细信息 |
|
将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是( ) A.2∶3 B.3∶2 C.1∶2 D.1∶1 |
|
| 12. 选择题 | 详细信息 |
|
松花皮蛋是夏季餐桌上的一道美食,其制作的原料有纯碱、食盐、生石灰、草木灰(内合碳酸钾)、开水以及糠、稻壳等辅料,配料之间首先是生石灰与水反应生成熟石灰,试推断另外最有可能发生的化学反应是( ) A.化合反应 B.分解反应 C.复分解反应 D.置换反应 |
|
| 13. 选择题 | 详细信息 |
|
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质在反应中的产物与物质的浓度有关的是( ) ①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 A.①③ B.③④ C.①② D.①③④ |
|
| 14. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A. 纯净物一定由分子构成 B. 同种分子构成的物质一定是纯净物 C. 混合物肯定由两种以上元素组成 D. 含有氧元素的化合物都是氧化物 |
|
| 15. 实验题 | 详细信息 | ||||||||||||||||
某溶液有Cl-、CO32-、SO42-,要求依次检验出这三种离子,请完成下列实验设计:
|
|||||||||||||||||
| 16. 填空题 | 详细信息 |
|
用双线桥法标出下列反应电子转移的方向和数目。 (1)4HCl(浓)+MnO2 (2)2KClO3 (3)Cl2+2NaOH===NaClO+NaCl+H2O__________ (4)2H2O2 (5)S+2H2SO4(浓) (6)6HCl+KClO3===3Cl2↑+KCl+3H2O__________ (7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O__________ (8)2KMnO4 |
|
| 17. 填空题 | 详细信息 |
|
今有11种物质:①铝线;②石墨;③氯气;④BaSO4晶体;⑤纯硫酸;⑥金刚石;⑦石灰水;⑧乙醇;⑨熔融的KNO3;⑩NH3;⑪盐酸。其中: (1)能导电的是(填序号,下同)____________________________; (2)属于电解质的是___________________________________; (3)属于非电解质的是_______________________________; (4)既不是电解质又不是非电解质的是_____________________。 |
|
| 18. 实验题 | 详细信息 |
|
某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。请你填出该同学实验中出现了以下现象时应得出的结论: (1)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,结论是_______。 (2)若滴入酸性高锰酸钾溶液后不褪色,滴入KSCN溶液变红,结论是_______。 (3)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液变红,结论是____。 (4)不能将KMnO4和KSCN滴入到同一试管中进行验证,试进行解释_______。 |
|
| 19. 实验题 | 详细信息 |
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: (1)①装置A中发生反应的离子方程式是______________。 ②整套实验装置存在一处明显的不足,请指出_______________________。 (2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。 为探究上述实验现象的本质,小组同学查得资料如下:  ①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________溶液,若溶液颜色________,则上述解释是合理的。 ②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________。 |
|
| 20. 填空题 | 详细信息 |
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下: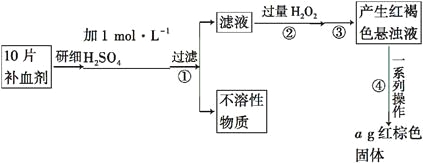 请回答下列问题: (1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加____,该过程的现象为__________________________________________________。 (2)步骤②加入过量H2O2的目的是___________________________________。 (3)步骤③中反应的离子方程式是__________________________________。 (4)步骤④中一系列处理的操作步骤:过滤、____________、灼烧、______、称量。 (5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为____g。 |
|
| 21. 计算题 | 详细信息 |
|
铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。根据题意完成: (1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s)__________g。 (2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)_____mL。 (3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。 计算: ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度____(溶液体积变化忽略不计)。 ②推算该产品的化学式____(写出推算过程)。 |
|
| 22. 计算题 | 详细信息 |
| 在2 L硫酸铜和硫酸铁的混合溶液中,加入30 g铁粉,最后得到2 L 0.25 mol·L-1的硫酸亚铁溶液及26 g固体沉淀物。分别求原混合溶液中硫酸铁和硫酸铜的物质的量浓度。 | |
| 23. 填空题 | 详细信息 |
| 稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F=6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是____________,还原剂是______________,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为____________。 | |
最近更新



