大庆市2018年高二上期化学期中考试网络考试试卷
| 1. 选择题 | 详细信息 |
|
2SO2(g)+O2(g) A. 催化剂V2O5不改变该反应的逆反应速率 B. 保持容器体积不变,通入稀有气体增大反应体系的压强,反应速率一定增大 C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间 D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=(c2-c1)/(t2-t1) |
|
| 2. 选择题 | 详细信息 |
|
一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响生成氢气的量,可向其中加入 A. KCl固体 B. 铁粉 C. K2SO4溶液 D. KNO3溶液 |
|
| 3. 选择题 | 详细信息 |
|
向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应: N2(g)+3H2(g) A. 该反应达平衡时H2的转化率为40% B. 降低温度能使混合气体的密度增大 C. 向该容器中充入N2,平衡正向移动 D. 研发高效催化剂可大大提高N2的转化率 |
|
| 4. 选择题 | 详细信息 |
|
下列不能用勒夏特列原理解释的事实是( ) A.棕红色的NO2加压后颜色先变深后变浅 B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 C.黄绿色的氯水光照后颜色变浅 D.合成氨工业使用高压以提高氨的产量 |
|
| 5. 选择题 | 详细信息 |
|
25℃时,水的电离平衡H2O⇌H++OH-△H>0.下列叙述正确的是( ) A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B. 向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 C. 向水中加入少量盐酸,平衡逆向移动,c(H+)降低 D. 将水加热,Kw增大,c(H+)不变 |
|
| 6. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. SO2溶于水,其水溶液能导电,说明SO2是电解质 B. 用广泛pH试纸测得0.10mol/LNH4Cl溶液的pH=5.2 C. 若25.00ml滴定管中液面的位置在刻度为3.00ml处,则滴定管中液体的体积一定大于22.00ml D. 常温下用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3,则常温下Ksp(BaSO4)>Ksp(BaCO3) |
|
| 7. 选择题 | 详细信息 |
下列说法正确的是 ( ) A. 碱式滴定管注入Na2CO3溶液之前应检查是否漏液 B. 测定盐酸浓度 C. 蒸干AlCl3饱和溶液制备AlCl3晶体 D. 记录滴定终点读数为12.20 ml |
|
| 8. 选择题 | 详细信息 |
|
室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是( ) A. 溶液中导电粒子的数目增加,导电性增强 B. 醋酸的电离程度增大,pH增大 C. 再加入10mLpH=11NaOH溶液,混合液pH>7 D. 溶液中c(CH3COO—)/c(CH3COOH)c(OH—)变小 |
|
| 9. 选择题 | 详细信息 |
|
下列离子方程式属于盐的水解,且书写正确的是( ) A. NaHCO3溶液:HCO3—+H2O B. NaHS溶液:HS-+H2O C. Na2CO3溶液:CO32—+2H2O D. KF溶液:F-+H2O = HF+OH- |
|
| 10. 选择题 | 详细信息 |
|
一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小 C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小 |
|
| 11. 选择题 | 详细信息 |
|
下列应用与盐的水解无关的是( ) A. NH4Cl与ZnCl2溶液可作焊接中的除锈剂 B. 用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 C. 氯化钠可用作防腐剂和调味剂 D. 实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞 |
|
| 12. 选择题 | 详细信息 |
|
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是: A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
|
| 13. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 25 ℃时NH4Cl溶液的Kw大于100 ℃时NaCl溶液的Kw B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O====SO32―+2I―+4H+ C. 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2―、NO3- D. 100 ℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
|
| 14. 选择题 | 详细信息 |
|
对于0.1 mol·L-1 Na2SO3溶液,正确的是( ) A. c(H+) +c(HSO3-) +2c(H2SO3) =c(OH-) B. c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) C. c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) D. 升高温度,溶液pH降低 |
|
| 15. 选择题 | 详细信息 |
|
下列溶液中有关物质的量浓度关系正确的是( ) A. 0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) B. NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) C. 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D. 常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol/L |
|
| 16. 选择题 | 详细信息 | ||||||||
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
|
|||||||||
| 17. 选择题 | 详细信息 |
对利用甲烷消除NO2污染进行研究,反应原理为CH4+2NO2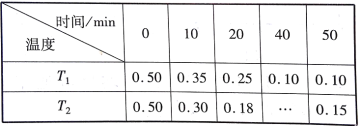 下列说法正确的是( ) A. T1温度下,0~20 min内,NO2的降解速率为0.0125 mol·L-1·min-1 B. 由实验数据可知实验控制的温度T1<T2 C. 40min时,表格中T2应填的数据为0.18 D. 0~10 min内,CH4的降解速率T1> T2 |
|
| 18. 选择题 | 详细信息 |
室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )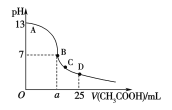 A. 在A、B间任一点,溶液中一定都c(Na+)+c(H+)=c(CH3COO-)+c(OH-) B. 在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+) C. 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D. 在D点:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1 |
|
| 19. 填空题 | 详细信息 |
|
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应:N2(g)+O2(g) (1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_____________________。 (2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ 。 A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变 C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO) (3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图变化趋势正确的是____________(填字母序号)。 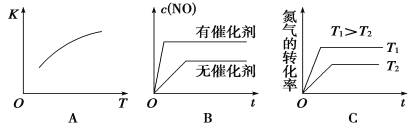 (4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”) (5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应___________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是________________________________ 。 |
|
| 20. 综合题 | 详细信息 |
|
按要求填空: (1)AlCl3的水溶液 pH______7(填>、=、<),其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是______(填化学式)。 (2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH−)=10−32,要使c(Cr3+)降至10−5mol/L,溶液的pH应调至_____。 (3)物质的量浓度相同的三种溶液:①NH4Cl ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______________。 (用序号表示) (4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为____________________。 (5)室温,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸的体积比为____________。 |
|
| 21. 实验题 | 详细信息 | ||||||||||||||||||
|
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验。请完成下列填空: (1)配制500mL 0.1000mol·L-1 NaOH 标准溶液。 ①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、__________、__________等。 ②称取__________g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、__________ (2)取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用__________(填仪器名称)盛装配制的标准NaOH溶液进行滴定。重复上述滴定操作2〜3次,记录数据如下:
|
|||||||||||||||||||
| 22. 综合题 | 详细信息 |
|
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。 (1)NOx和SO2在空气中存在下列平衡:2NO(g) + O2(g) ① 写出NO2和SO2反应的热化学方程式为__________________________。 ② 随温度升高,该反应化学平衡常数变化趋势是____________。(填“增大”或“减小”或“不变”) (2)提高2SO2 + O2 ① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该温度下反应的平衡常数K=_______。 ② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_________(填字母)。 a.温度和容器体积不变,充入1.0 mol He b.温度和容器体积不变,充入1.0 mol O2 c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,升高体系温度 (3)汽车尾气是氮氧化物的一个主要来源。汽缸中生成NO的反应为:N2 (g) + O2 (g) 汽车启动后,汽缸温度越高,单位时间内NO的排放量越大,其原因是_______________。 (4)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。 ① 写出用CO还原NO生成N2的化学方程式____________________。 ② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。 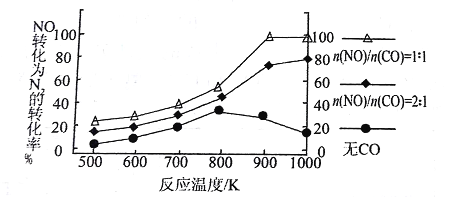 为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为________、________;该反应的∆H________0(填“>”、“<”或“=”)。 |
|
最近更新




