云南省弥勒市第二中学2020届高三前半期开学考试化学考题
| 1. 选择题 | 详细信息 |
|
石英用来制造坩埚是因为( ) A. 高温下,石英与任何化学试剂都不反应,石英熔点高、耐高温 B. 石英耐酸性能好,与任何酸都不反应 C. 石英熔点高、耐高温 D. 石英硬度小,易于加工处理 |
|
| 2. 选择题 | 详细信息 |
|
在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦ |
|
| 3. 选择题 | 详细信息 |
|
刻制印刷电路板时,用FeCl3溶液作为“腐蚀液”,发生反应为Cu+2Fe3+═2Fe2++Cu2+.根据该反应判断下列说法不正确的是( ) A. Cu是还原剂 B. Fe3+具有氧化性 C. 该反应是置换反应 D. 该反应属于离子反应 |
|
| 4. 选择题 | 详细信息 |
|
绿色化学概念从一提出来,就明确了它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节都实现净化和无污染的反应途径。下列化工生产中体现绿色化学内涵的是( )。 ①减少“三废”排放量 ②考虑有关原材料的再生利用 ③出现污染问题再治理 ④回收未反应的原料、副产物、助溶剂、稳定剂等非反应试剂 ⑤拒绝使用无法替代、无法回收、无法再生和重复使用的有毒副作用、污染明显的原料 A.①③④ B.①②③⑤ C.①②④⑤ D.②③④⑤ |
|
| 5. 选择题 | 详细信息 |
|
在前一个分散系中慢慢地滴入后一种分散系所观察到的现象不是先沉淀后变澄清的是( ) A. 氢氧化铁胶体中滴加硫酸 B. 偏铝酸钠溶液中滴加盐酸 C. 氯化铝溶液中滴加烧碱溶液 D. 氯化铝溶液中滴加氨水 |
|
| 6. 选择题 | 详细信息 |
|
已知某有机物0.1 mol完全燃烧时,可产生二氧化碳和水共0.4 mol,该有机物不可能是( ) A. C2H4 B. CH3CHO C. CH3COOH D. CH3CH2OH |
|
| 7. 选择题 | 详细信息 |
|
下列反应中,可用离子方程式 A.碳酸钙和足量盐酸的反应 B.碳酸钠溶液与氯化钙溶液的反应 C.碳酸钠溶液与足量稀硝酸反应 D.碳酸钡和足量硫酸的反应 |
|
| 8. 填空题 | 详细信息 |
|
向浓度相等、体积均为50ml的A、B两份氢氧化钠溶液中分别通入一定量的二氧化碳后,再稀释至100ml。 (1)向氢氧化钠溶液中通入一定量的二氧化碳后,溶液中溶质的可能组成有:①______;②_______; ③_______;④_______。 (2)向稀释后的溶液中逐滴加入0.1mol/L的盐酸溶液,产生二氧化碳的体积(标准状况)与所加盐酸溶液的体积关系如图所示。 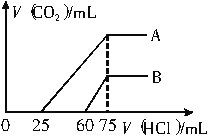 ①A曲线表明,向原溶液中通入二氧化碳后,所得溶质与HCl反应产生二氧化碳的最大体积是_______mL(标准状况)。 ②B曲线表明,向原溶液中通入二氧化碳后,所得溶液中溶质的化学式为___________。 ③原氢氧化钠溶液中NaOH的物质的量浓度为__________。 |
|
| 9. | 详细信息 |
海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料时,设计了以下操作流程: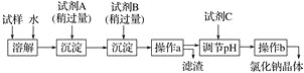 请回答以下问题: (1)在所提供的试剂中选择:试剂B是____。 ①Na2CO3 ②BaCl2 ③稀盐酸 (2)操作b中用到的主要仪器为酒精灯、____、三脚架和玻璃棒。 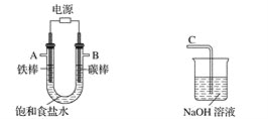 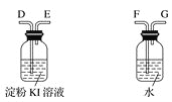 (3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按上图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是: A接___,___接____;B接____,____接____。 (4)电解氯化钠溶液时的离子方程式为________。 |
|
| 10. 综合题 | 详细信息 |
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示: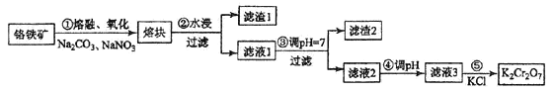 回答下列问题: (1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。 (2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。 (3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。 (4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。 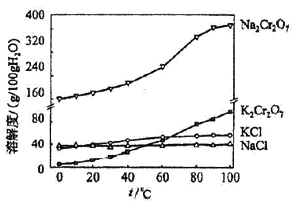 a.80℃ b.60℃ c.40℃ d.10℃ 步骤⑤的反应类型是___________________。 (5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。 |
|
| 11. 综合题 | 详细信息 |
5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下: 甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表: 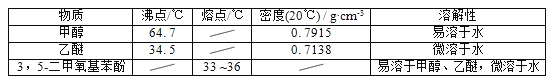 (1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层; (2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______; (3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母); a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥 (4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。 |
|
| 12. 综合题 | 详细信息 |
有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。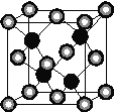 请回答下列问题: (1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。 (2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。 (3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。 (4)L的价电子排布式为________,该元素位于周期表中的________族。 (5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示) |
|
高中化学 试卷推荐
- 2018-2019年高二上册半期考试化学在线测验完整版(四川省遂宁二中)
- 2019-2020年高二下学期期末考试化学题同步训练免费试卷(河北省秦皇岛市卢龙县木井中学)
- 2018-2019年高二上册期末考试化学在线测验完整版(湖南省永州市祁阳县)
- 云南师范大学附属中学2021届高三高考适应性月考卷理科综合化学网上检测无纸试卷带答案和解析
- 江西省永丰县永丰中学2020-2021年高一前半期期中考试化学免费试题带答案和解析
- 教考联盟2019年高三下半年化学高考模拟附答案与解析
- 2019-2020年高一上册期中考试化学考题同步训练(江苏省连云港市赣榆区海头高级中学)
- 全国2019年高二下册化学假期作业免费检测试卷
最近更新



