湖南省永州市2020届高三“培优”理综化学模拟试卷带参考答案和解析
| 1. 选择题 | 详细信息 | ||||||||||
新冠疫情暴发,消毒剂成为紧俏商品,下列常用的消毒剂中,消毒原理与氧化还原无关的是( )
|
|||||||||||
| 2. 选择题 | 详细信息 |
有机物M、N、Q的转化关系为:  下列说法正确的是( ) A.M分子中的所有原子均在同一平面 B.上述两步反应依次属于加成反应和取代反应 C.M与H2加成后的产物,一氯代物有6种 D.Q与乙醇互为同系物,且均能使酸性KMnO4溶液褪色 |
|
| 3. 选择题 | 详细信息 |
天然海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电时燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:下列说法错误的是( ) A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸 D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同 |
|
| 4. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验的图示及分析均正确的是( )
|
|||||||||||||||||||||
| 5. 选择题 | 详细信息 |
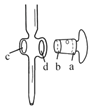
HIO3是强酸,其水溶液是强氧化剂。工业上,以KIO3为原料可制备HIO3。某学习小组拟用如图装置制备碘酸。M、N为惰性电极,ab、cd为交换膜。下列推断错误的是( ) A.光伏电池的e极为负极,M极发生还原反应 B.在标准状况下收集6720mLX和Y的混合气体时KIO3溶液减少3.6g C.Y极的电极反应式为2H2O-4e-═O2↑+4H+ D.制备过程中要控制电压,避免生成HIO4等杂质 |
|
| 6. 选择题 | 详细信息 |
|
H2S为二元弱酸。20℃时,向0.100mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) A.c(Cl-)=0.100mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-2c(S2-) B.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+) C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100mol·L-1+c(H2S) D.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S) |
|
| 7. 选择题 | 详细信息 | |||||||||||||||
几种短周期元素的原子半径及主要化合价如下表:
|
||||||||||||||||
| 8. | 详细信息 | ||||||||||||||||||||
|
双氧水在医疗、军事和工业上用途广泛,工业上合成双氧水的方法有多种,其中一种合成工艺为乙基蒽醌(EAQ)法。 已知: ①反应原理为  ②工业制备流程如图所示。 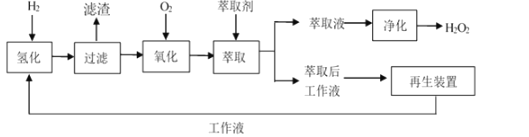 ③制备过程中,将EAQ溶于有机溶剂中配制成工作液。 请回答下列问题: (1)该流程中,循环使用的原料为___。 (2)现有甲、乙、丙三种有机溶剂,相关物质的溶解情况如表所示,则配制工作液时,应选用有机溶剂__(填“甲”“乙”或“丙”),原因为___。
|
|||||||||||||||||||||
| 9. | 详细信息 | ||||||||||||||
某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)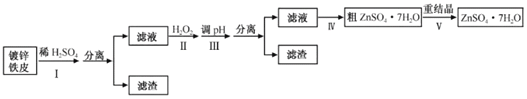 相关信息如下: ①金属离子形成氢氧化物沉淀的相关pH范围。
|
|||||||||||||||
| 10. 综合题 | 详细信息 |
|
合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g) (1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。 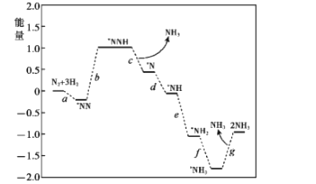 ①NH3的电子式是___。 ②决定反应速率的一步是___(填字母a、b、c、…)。 ③由图象可知合成氨反应的△H____0(填“>”、“<”或“=”)。 (2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入5molN2、15molH2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:  ①温度T1、T2、T3大小关系是___。 ②M点的平衡常数K=____(可用分数表示)。 (3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:  ①导线中电子移动方向是____。 ②固氮酶区域发生反应的离子方程式是___。 ③相比传统工业合成氨,该方法的优点有___。 |
|
| 11. 综合题 | 详细信息 |
|
形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。 (1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。 (2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___。乙炔钠中存在___(填字母)。 A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力 (3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____。写出和该阴离子互为等电子体的一种分子的结构式___。 (4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____。 (5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。 (6)某离子晶体的晶胞结构如图所示。  ①晶体中在每个X周围与它最近且距离相等的X共有___个。 ②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。 |
|
| 12. 推断题 | 详细信息 |
具有抗菌作用的白头翁素衍生物I的合成路线如图所示: 已知: ⅰ.R-HC=CH-R’+R”COOH ⅱ.R-HC=CH-R” 回答下列问题: (1)反应①的反应类型是___。 (2)写出反应②的化学方程式是___。 (3)合成过程中设计步骤①和④的目的是___。 (4)试剂a是___。 (5)下列说法正确的是___(选填字母序号)。 a.物质A极易溶于水 b.③反应后的试管可以用硝酸洗涤 c.F生成G的反应类型是取代反应 d.物质D既能与盐酸反应又能与氢氧化钠钠溶液反应 (6)由F与I2在一定条件下反应生成G的化学方程式是___;此反应同时生成另外一个有机副产物且与G互为同分异构体,此有机副产物的结构简式是___。 (7)已知:RCH2Br 以乙烯起始原料,结合已知信息选用必要的无机试剂合成  ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___。 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___。 |
|