宜宾市2019年高三化学上半年期末考试免费试卷完整版
| 1. 选择题 | 详细信息 |
|
“一带路(OneBelt AndOneRoad)”构建人类命运共同体,符合国际社会的根本利益,彰显著人类社会的共同理想和关好追求。下列贸易的商品中,其主要成分属于无机物的是 A. 中国丝绸 B. 埃及长绒棉 C. 乌克兰葵花籽油 D. 捷克水晶 |
|
| 2. 选择题 | 详细信息 |
二羟甲戊酸是生物合成青蒿素的原料之一,其结构如图所示。下列关于二羟甲戊酸的说法正确的是 A. 分子式为C3H14O4 B. 能使酸性KMnO4溶液褪色 C. 能发生加成反应,不能发生取代反应 D. 1mol该有机物与足量金属钠反应产生22.4L H2 |
|
| 3. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A. 2.4gMg在空气中完全燃烧,转移电子数一定为0.2NA B. 标准状况下,2.24L HF中所含原子总数一定为0.2NA C. 5.6gFe在稀硝酸中完全溶解,转移电子数一定为0.2NA D. 12.0g熔融的NaHSO4中,阳离子的总数一定为0.2NA |
|
| 4. 选择题 | 详细信息 |
|
常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体。NA代表阿伏加德罗常数的值,下列说法正确的是 A. pH=3的草酸溶液含有H+数目为0.001NA B. 当1molKMnO4被还原时强酸提供H+数目为NA C. 1molHOOC-COOH含共用电子对数目为9NA D. 该反应释放CO2分子数目为 |
|
| 5. 选择题 | 详细信息 |
|
四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述错误的是 A. 气态氢化物的热稳定性:b<c B. 含d元素的盐溶液可能呈碱性 C. 原子半径:d>c>b>a D. a、b和c三种元素能形成离子化合物 |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||||||||
利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)
|
|||||||||||||||||||||||||||
| 7. 选择题 | 详细信息 |
常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是 A. 对两种弱酸滴定均可选用甲基橙作指示剂 B. ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH) C. 溶液中水的电离程度:②>③>④ D. 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
|
| 8. 实验题 | 详细信息 |
|
过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题: (一)碳酸钙的制备  (1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。 (2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。  a.漏斗末端颈尖未紧靠烧杯壁 b.玻璃棒用作引流 c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗 e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度 (二)过氧化钙的制备  (3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。 (4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。 (5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。 (6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。 |
|
| 9. 综合题 | 详细信息 | |||||||||||||||
|
甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2 和H2)在催化剂的作用下合成甲醇,发生的主要反应如下: I.CO(g)+2H2(g) II.CO2(g)+H2(g) III.CO2(g)+3H2(g)
|
||||||||||||||||
| 10. 综合题 | 详细信息 |
用含SO2的硫酸工业尾气联合制备(NH4)2SO4和MnxOy,其工艺流和如下: (1)反应I的化学方程式为__________;反应II控制温度60℃~70℃之间的原因是________。反应I到反应II的过程中可循环利用的物质是__________________。 (2)反应III中以SO2作___________剂。 (3)MnCO3的作用是除去滤液中的Fe3+,写出除去Fe3+的离子反应方程式___________。 (4)MnS的作用是提供S2-除去Ni2+和Cu2+;当Ni2+恰好完全沉淀时[c(Ni2+)= 1.0×10-5 mol·L -1〕,溶被中Cu2+的浓度是_______ mol·L -1(已知Ksp(CuS)=8.4×10-45, Ksp(NiS)=1.4×10-24,) 。 (5)从MnSO4溶液中获得MnSO4·nH2O的方法是_____________。 (6) “锻烧”时温度与剩余固体质量变化曲线如下图: 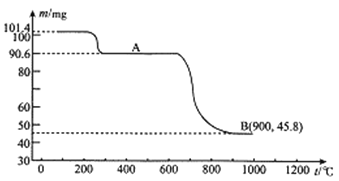 该曲线中B点所表示的固体氧化物的化学式为_______________。 |
|
| 11. 填空题 | 详细信息 |
|
铜、磷及其化合物是非常重要的物质。 (1)Cu+的电子排布式____; (2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个; (3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____; (4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____; (5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。 |
|
| 12. 推断题 | 详细信息 |
格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料( (1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。 (2)写出下列物质的结构简式: E____ , F____。 (3)写出苯 → C的化学方程式:____ (4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。 (5)设计原料(  )的合成路线:____ )的合成路线:____ |
|






