新疆喀什第二中学2018年高一化学上学期期末考试免费试卷完整版
| 1. 选择题 | 详细信息 |
|
化学与生产、生活密切相关。下列说法错误的是 A. 新能源汽车的推广和使用,有助于减少光化学烟雾的产生 B. 燃煤中加入适量石灰石,可以减少SO2的排放 C. 加强城市生活污水脱氮脱磷处理,遏制水体富营养化 D. Na2O2和Na2O皆可用作呼吸面具中的供氧剂 |
|
| 2. 选择题 | 详细信息 |
|
《本草纲目》中“烧酒”条目写道:“自元时始创其法,用浓酒和糟人甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”文中所用之“法”是指 ( ) A.蒸馏 B.渗析 C.萃取 D.过滤 |
|
| 3. 选择题 | 详细信息 |
|
下列叙述错误的是 ( ) A.试管内壁附着的硫可用二硫化碳洗涤 B.溶液和胶体的本质区别是有无丁达尔效应 C.分液漏斗和容量瓶在使用前都要检查是否漏水 D.玻璃钢是一种以玻璃纤维做增强体、合成树脂做基体的复合材料 |
|
| 4. 选择题 | 详细信息 | |||||||||||||||||||||||||
表中物质的分类正确的是 ( )
|
||||||||||||||||||||||||||
| 5. 选择题 | 详细信息 |
|
下列变化中,需要加入适当的还原剂才能完成的是 A. FeCl3→FeCl2 B. Cu→Cu2(OH)2CO3 C. SO3→H2SO4 D. HCl→Cl2 |
|
| 6. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 ( ) A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- B.碳酸钙与盐酸反应:CO32-+2H+=CO2+H2O C.稀硫酸与氢氧化钡溶液反应:H++OH-=H2O D.小苏打溶液与氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O |
|
| 7. 选择题 | 详细信息 |
|
下列叙述正确的是 ( ) A.浓盐酸和浓硝酸均应保存在棕色试剂瓶中 B.稀释浓硫酸时一定将水沿器壁缓缓注入浓硫酸中并不断搅拌 C.用CO2气体和NaOH溶液可以完成喷泉实验 D.金属钠着火时,可以用泡沫灭火器来灭火 |
|
| 8. 选择题 | 详细信息 |
|
配制一定物质的量浓度的溶液,以下操作导致溶液物质的量浓度偏小的是 A. 容量瓶中原来有少量蒸馏水 B. 用浓硫酸配制稀硫酸,量取浓硫酸时仰视刻度线 C. 定容时俯视容量瓶凹液面的最低处 D. 定容后摇匀液面下降补加蒸馏水至刻度线 |
|
| 9. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验的操作、现象、解释或结论都正确的是
|
|||||||||||||||||||||
| 10. 选择题 | 详细信息 |
用下列装置进行相关实验,操作正确且能达到实验目的的是 A. 甲装置:称30.0gNaOH固体 B. 乙装置: 过滤除去溶液中的不溶性杂质 C. 丙装置:除去CO2中混有的HCl气体 D. 丁装置: 吸收实验室制NH3的尾气 |
|
| 11. 选择题 | 详细信息 |
|
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,反应中氧化产物和还原 产物的物质的量之比是 A. 1:1 B. 1:3 C. 2:3 D. 3:1 |
|
| 12. 选择题 | 详细信息 |
|
下列有关物质性质与用途具有对应关系的是 A. 氢氧化钠固体易吸水潮解,可用于干燥二氧化碳 B. Ca(ClO)2具有还原性,可用于自来水的杀菌消毒 C. NH4HCO3受热易分解,可用作氮肥 D. 维生素C具有还原性,可用作食品抗氧化剂 |
|
| 13. 选择题 | 详细信息 |
|
下列各组中两种物质作用时,温度和反应物用量改变不会引起产物种类变化的是 ( ) A.Na和O2 B.S和O2 C.CO2和Ca(OH)2溶液 D.Fe和稀硝酸 |
|
| 14. 选择题 | 详细信息 |
|
在无色透明溶液中可以大量共存的离子组是 A. H+、K+、I- NO3- B. OH-、Cl-、Na+、NH4+ C. Mg2+、K+、Cl-、NO3- D. Cu2+、NO3-、OH-、Cl- |
|
| 15. 选择题 | 详细信息 |
|
在反应3Cl2+6KOH A.Cl2是氧化剂,KOH是还原剂 B.KCl是氧化产物,KClO3是还原产物 C.被还原氯气与被氧化氯气的质量比为5:1 D.反应中转移电子的物质的量为6mol时,消耗3molCl2 |
|
| 16. 选择题 | 详细信息 |
|
NA为阿伏加德罗常数的值。下列说法正确的是 A. 常温常压下,11.2L N2含有的原子数目为NA B. 5. 6g铁单质与足量盐酸完全反应,失电子总数为0.3NA C. 0.1 md • L-1的Na2CO3溶液中含有Na+的个数为0.2 NA D. 常温常压下,4. 6gNO2和N2O4的混合气体中含有的氧原子数为0.2 NA |
|
| 17. 选择题 | 详细信息 |
|
某溶液中有Mg2+、Fe2+、Al3+、Cu2+4种离子,若向其中加入过量的Na2O2固体,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 A. Cu2+ B. Mg2+ C. Fe2+ D. Al3+ |
|
| 18. 选择题 | 详细信息 | ||||||||||||||||||||
下列各组物质中,物质之间不可能实现如图所示变化的是( )
|
|||||||||||||||||||||
| 19. 填空题 | 详细信息 |
|
材料与生产、生活和科技密切相关。回答下列问题: (1)无机非金属材料与我们的生活联系密切。我国具有独立知识产权的电脑芯片“龙芯一号”填补了我国计算机史上空白,“龙芯一号”材料的化学式为______;传统的无机非金属材料在日常生活中有着广泛的运用。玻璃和水泥的生产中均用到的原料的名称是____,其中碳酸钠在玻璃熔炉中反应的化学方程式为____________。 (2)金属材料的应用更是广泛。工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是________;用实验判定腐蚀液中含有Fe2+离子______________。 |
|
| 20. 实验题 | 详细信息 |
化学上常见的混合物分离或提纯的基本装置如下: (1)写出仪器名称:a___________,b__________。 (2)从海带提取碘的操作如下,除特殊说明外,请在空白处填上装置中的序号:将干海带进行灼烧,海带灰中含有较多KI,将海带灰溶于水,然后__________得到澄清滤液;向滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。该反应的离子方程式为:__________________。向碘的水溶液中加入适量CCl4,进行___________操作将上下两层溶液分开。将含有碘的CCl4溶液置于蒸馏烧瓶内进行___________操作,可以粗略从CCl4溶液中分离出碘。 |
|
| 21. 实验题 | 详细信息 |
|
某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。 (1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。 (2)下图是该同学配制的一些关键步骤和操作图。 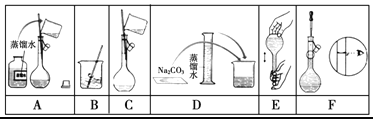 配制过程的先后顺序为(用字母A~F填写)________________。 (3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将________(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将_______(填“偏高”、“偏低”、“不变”)。 |
|
| 22. 实验题 | 详细信息 |
氯气是一种重要的化工原料,能与有机物和无机物进行反应生成多种氯化物。现用下图装置制取氯气并进行一系列的实验探究。 回答下列问题: (1)装置1是用来制备纯净、干燥的氯气: ①装置A中圆底烧瓶内发生反应的离子方程式是______________________,反应中被氧化的HCl与消耗的HCl物质的量之比为________________。 ②装置B内试剂为_____________,装置C的作用是_____________。 (2)①若将装置1与装置2连接制备少量氯化铁固体(氯化铁易吸水,在300℃时升华),则:D中发生反应的化学方程式为_______________________________。 ②若在D装置的硬质玻璃管内装入石英沙和碳粉,则发生如下反应:SiO2+2C+2Cl2 (3)将装置1与装置3连接来探究氯气是否具有漂白性。 ①将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_____________________。 ②为防止氯气尾气污染空气,根据氯水显酸性的性质,可用氢氧化钠溶液吸收多余的氯气,原理是(用离子方程式表示)______________________________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_____________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______________(用字母代号填)。 A.O2 B.H2 C.CO2 D.HClO |
|
| 23. 综合题 | 详细信息 |
|
A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)。 (1)若A为有刺激性气味的气体,溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。 ①实验室制取气体A的化学方程式_____________; ②写出A→B的化学方程式为_____________; ③写出Cu与D稀溶液反应生成B的离子方程式_____________; (2)若A、B、C 三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发袍剂,受热分解可生成B。 ①写出A溶液与C溶液反应的离子方程式为_____________; ②向两份30mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25mol/L盐酸,如图所示I和II分别为加入V(盐酸)与产生V(W)的关系。则A溶液的物质的量浓度为_____________,M、N 两溶液中相同溶质的物质的量之比为_____________;  |
|
最近更新



