河北省石家庄市元氏县第四中学2020-2021年高一上学期期中考试化学题同步训练免费试卷
| 1. 选择题 | 详细信息 |
|
标准状况下,等质量的下列气体所占有的体积最大的是( ) A.O2 B.CH4 C.CO2 D.SO2 |
|
| 2. 选择题 | 详细信息 |
|
同温同压下,两种气体的体积如果不同,其主要原因是 A.气体的分子大小不同 B.气体分子间的平均距离不同 C.气体的物质的量不同 D.气体的性质不同 |
|
| 3. 选择题 | 详细信息 |
|
下列物质属于电解质的是 A.食盐水 B.CO2 C.石墨 D.HCl |
|
| 4. 选择题 | 详细信息 |
|
下列反应方程式中有一个与其他三个在分类上不同,这个反应是( ) A. 3Fe+2O2 B. C+CO2 C. NH4HCO3 D. Na2CO3+CO2+H2O=2NaHCO3 |
|
| 5. 选择题 | 详细信息 |
|
将一小粒金属钠投入到盛有冷水的小烧杯中,以下描述合理的是( ) A.无明显现象 B.烧杯内有白色沉淀生成 C.金属钠浮于液面上,四处游动 D.金属钠沉入烧杯底部,并产生气泡 |
|
| 6. 选择题 | 详细信息 |
|
下列有关阿伏加德罗常数(NA)的说法错误的是( ) A. 32gO2所含的原子数目为NA B. 0.5molH2O含有的原子数目为1.5NA C. 1molH2O含有的H2O分子数目为NA D. 0.5NA个CO2的物质的量是0.5mol |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是 A. 硫酸钡不溶于水,所以硫酸钡是非电解质 B. 二氧化碳溶于水可以导电,所以二氧化碳是电解质 C. 硫酸是电解质,所以硫酸在熔化时或溶于水时都能导电 D. 液态氯化氢不导电,但氯化氢是电解质 |
|
| 8. 选择题 | 详细信息 |
|
下列物质常用作氧化剂的是 A. CO B. Al C. FeCl3 D. H2 |
|
| 9. 选择题 | 详细信息 |
|
下列化学变化中,不需要另外加入氧化剂就可以实现的是 A. H2O2→O2 B. KI→I2 C. Cu→CuO D. CH4→CO2 |
|
| 10. 选择题 | 详细信息 |
|
下列溶液中Cl-浓度与50mL1mol·L-1AlCl3溶液中Cl-的物质的量浓度相等的是( ) A.175mL1mol·L-1的FeCl3溶液 B.75mL2mol·L-1NH4Cl溶液 C.150mL1mol·L-1的KCl溶液 D.50mL1mol·L-1的NaCl溶液 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||
用如图表示的一些物质或概念间的从属关系不正确的是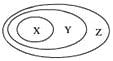
A.A B.B C.C D.D |
|||||||||||||||||||||
| 12. 选择题 | 详细信息 |
|
下列反应可用离子方程式“H++OH-=H2O”表示的是 A.H2SO4溶液与Ba(OH)2溶液混合 B.NH4Cl溶液与Ca(OH)2溶液混合 C.NaHSO4溶液与KOH溶液混合 D.H2SO4溶液与Fe(OH)3胶体混合 |
|
| 13. 选择题 | 详细信息 |
|
在反应H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,若有32g硫生成则转移电子为( ) A.6 mol B.2 mol C.3 mol D.4 mol |
|
| 14. 选择题 | 详细信息 |
|
水溶液中能大量共存的一组离子是 A.Na+、OH-、Cl-、 C.Mg2+、 |
|
| 15. 选择题 | 详细信息 |
|
在溶液中,下列电离方程式不正确的是 A.Ba(OH)2=Ba2++2OH﹣ B.NaHSO4=Na++H++ C.NaHCO3=Na++ |
|
| 16. 选择题 | 详细信息 |
|
从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式有( ) A.Na B.NaCl C.NaOH D.Na2O2 |
|
| 17. 选择题 | 详细信息 |
|
下列关于钠的说法中不正确的是 A.金属钠和氧气反应,条件不同,产物则不同 B.若钠着火,可以用沙子灭火 C.钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 D.做完实验多余的钠,不能放回原来的试剂瓶 |
|
| 18. 选择题 | 详细信息 |
|
在某无色透明的酸性溶液中,能大量共存的离子组是 A.K+、Ba2+、Cl-、 C. |
|
| 19. 选择题 | 详细信息 |
|
下列关于实验室制Cl2的认识正确的是 A.还原剂是 MnO2 B.发生氧化反应的是HCl C.向含有4mol HCl的浓盐酸中加入足量MnO2并加热,反应过程中转移电子数为2NA D.收集Cl2宜采用向下排空气法收集 |
|
| 20. 选择题 | 详细信息 |
向一定体积的Ba(OH)2溶液中逐滴加入H2SO4溶液,测得混合溶液的导电能力随时间的变化曲线如下图所示。下列说法正确的是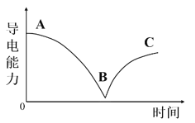 A.AB段溶液的导电能力不断减弱,说明产物BaSO4是非电解质 B.AB段反应的离子方程式为:Ba2++OH-+H++ C.BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离 D.BC段溶液中:Al3+、Na+、 |
|
| 21. 综合题 | 详细信息 |
|
回答下列问题。 (1)下列物质中:①SO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水。能导电的是__________(填序号,下同)。属于电解质的是__________。属于非电解质的是__________。 (2)1.204×1024个H2SO4分子的物质的量为__________mol,共含__________个氢原子。将上述H2SO4溶于水配成600 mL溶液,再加水稀释到1000 mL,稀释后溶液的物质的量浓度为__________mol/L。 (3)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为__________mol/L。 (4)Al2O3与稀盐酸反应的离子方程式为__________。向Ba(OH)2溶液中逐滴加入NaHSO4溶液至不再产生沉淀,离子方程式为__________。 |
|
| 22. 实验题 | 详细信息 | ||||
|
用质量分数为36.5%的盐酸(密度为1.16g•cm﹣3)配制1mol•L﹣1的稀盐酸.现实验室仅需要这种盐酸220mL,试回答下列问题: (1)配制稀盐酸时,除了用到量筒、烧杯、玻璃棒、胶头滴管,还需使用的玻璃仪器有 。 (2)计算已知盐酸的物质的量浓度为 。 (3)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
|
|||||
| 23. 实验题 | 详细信息 |
氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究: (1)仪器a的名称为______,装置B中饱和食盐水的作用是______。 (2)装置A中发生反应的离子方程式为___________。 (3)装置D中的实验现象为______,装置E中的实验现象为______。 (4)整套实验装置存在着明显缺陷,你的改进措施是______。 (5)反应结束后,证明仪器a内的溶液中含有Cl-的方法是______。 |
|
| 24. 填空题 | 详细信息 | ||||||||||||||||||||||||
已知1mol不同气体, 在不同条件下的体积
(1)对上表分析得出的结论是: |
|||||||||||||||||||||||||
| 25. 填空题 | 详细信息 |
|
请用双线桥法表示以下反应电子的转移情况: (1)2Na+2H2O=2NaOH+H2↑_____; (2)2H2S+SO2=3S↓+2H2O_____; (3)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O_____; (4)2KMnO4+16HCl=2KCI+2MnCl2+5Cl2↑+8H2O_____。 |
|



