南京市中华中学2020-2021年高一上册期中考试化学网上检测无纸试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
2020年新冠肺炎来势汹汹,肆虐全球。采取以下措施可以有效防治新冠病毒传染的是( ) A.平时教室要紧闭门窗,防止新冠病毒进入 B.大量饮用白酒达到杀灭新冠病毒的目的 C.“84”消毒液稀释后可用于室内外环境消毒,杀灭新冠病毒在内的多种病毒 D.注射流感疫苗可以有效预防新冠肺炎的传染 |
|
| 2. 选择题 | 详细信息 |
|
节日焰火绚烂多彩,这与高中化学中“焰色试验”知识相关。下列说法中正确的是( ) A.焰色试验是化学变化 B.用稀盐酸清洗做焰色试验的铂丝(镍丝或铁丝) C.利用焰色试验可区分NaOH与Na2CO3固体 D.焰色试验均应透过蓝色钴玻璃观察 |
|
| 3. 选择题 | 详细信息 |
|
对下列物质的用途及其解释合理的是 A.利用钠的还原性,还原硫酸铜溶液中的铜 B.氢氧化钠能与盐酸反应,可用于中和过多的胃酸 C.纯碱属于碱,可用来去除厨房油污 D.利用次氯酸钙的强氧化性,可以用漂白粉漂白纸张,游泳池消毒 |
|
| 4. 选择题 | 详细信息 |
|
加热Ca(HCO3)2时,发生反应:Ca(HCO3)2 A.分解反应 B.化合反应 C.置换反应 D.氧化还原反应 |
|
| 5. 选择题 | 详细信息 |
|
下列物质属于电解质且能导电的是( ) A.铜 B.熔融的氯化钠 C.稀硫酸 D.氢氧化钠 |
|
| 6. 选择题 | 详细信息 |
|
ClO2可用于自来水的杀菌消毒,它属于 A.酸 B.碱 C.盐 D.氧化物 |
|
| 7. 选择题 | 详细信息 |
|
下列分散系中能观察到丁达尔效应的是( ) A.豆浆 B.食盐水 C.油水混合物 D.冰水混合物 |
|
| 8. 选择题 | 详细信息 |
|
反应2Al+MoO3=Mo+Al2O3可用于制备金属钼(Mo)。下列关于该反应的说法正确的是( ) A.Al是氧化剂 B.Mo被氧化 C.Al失去电子 D.MoO3发生氧化反应 |
|
| 9. 选择题 | 详细信息 |
|
在含有大量的H+、Ba2+、NO A.CO |
|
| 10. 选择题 | 详细信息 |
|
用NA代表阿伏加德罗常数的值,下列说法正确的是( ) A.5.6gFe与足量氯气反应时失去的电子数为0.2NA B.常温常压下4.8gO2和O3的混合气体所含原子数为0.3NA C.0.3mol/LNa2SO4溶液中,所含Na+和SO D.标准状况下,11.2L水的质量为9g |
|
| 11. 选择题 | 详细信息 |
|
用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作正确的是( ) A. 称量时,将固体NaOH放在纸片上,放在天平左盘上称量 B. 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 C. 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 D. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 |
|
| 12. 选择题 | 详细信息 |
|
下列叙述中不正确的是 A. Na2O2是淡黄色固体, Na2O 是白色固体, 二者都能与水反应生成 NaOH B. Na和O2在加热时反应生成 Na2O2,在常温下反应生成 Na2O C. Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成 O2 D. 2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g |
|
| 13. 选择题 | 详细信息 |
|
下列关于Na2CO3和NaHCO3的说法中,不正确的是( ) A.相同条件下溶解度:Na2CO3>NaHCO3 B.二者的溶液可用加入澄清石灰水的方法区别 C.可以用加热的方法除去Na2CO3固体中的NaHCO3杂质 D.等质量的两种固体分别与足量盐酸反应,产生的CO2不一样多 |
|
| 14. 选择题 | 详细信息 |
|
同温同压下,相同体积的SO2和O3气体,下列叙述中错误的是 A. 质量比4∶3 B. 电子数比1∶1 C. 密度比4∶3 D. 氧原子数比2∶3 |
|
| 15. 选择题 | 详细信息 |
|
在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( ) A.新制氯水使淀粉KI试纸变蓝,说明有HCl B.光照新制氯水有气泡逸出,该气体是Cl2 C.将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO D.加入石蕊溶液,溶液先变红后褪色,说明该溶液含有HClO |
|
| 16. 选择题 | 详细信息 |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是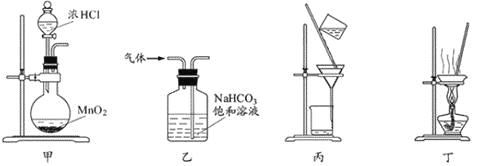 A. 用装置甲制取氯气 B. 用装置乙除去氯气中的少量氯化氢 C. 用装置丙分离二氧化锰和氯化锰溶液 D. 用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
|
| 17. 选择题 | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化均能实现的是( ) A.NaClO(aq) B.1mol·L-1HCl(aq) C.Fe(s) D.NaHCO3(s) |
|
| 18. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是( ) A.铁粉与稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ B.Na2CO3溶液与足量盐酸反应:CO C.Cu(OH)2固体与稀H2SO4反应:OH-+H+=H2O D.Cl2与水反应:Cl2+H2O=2H++Cl-+ClO- |
|
| 19. 选择题 | 详细信息 |
|
下列有关氧化还原反应Mn2++IO A.IO B.氧化性:MnO C.氧化剂和还原剂的物质的量之比为5∶2 D.若有1molMn2+参加反应,则转移10mol电子 |
|
| 20. 选择题 | 详细信息 |
|
钴的氧化物广泛应用于磁性材料及超导材料等领域。取一定量的钴的氧化物(其中钴的化合价为+2、+3价),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。通过计算可以确定该氧化物中Co、O的物质的量之比为 A.1:1 B.2:3 C.3:4 D.5:6 |
|
| 21. 实验题 | 详细信息 |
|
(1)用98%的浓硫酸配制3mol·L-1硫酸100mL,需要量取浓硫酸___(密度为1.84g·cm-3)mL。(保留一位小数)。 (2)配制过程部分操作如下,正确的顺序是___。 A.向容量瓶中注入适量蒸馏水,检查是否漏水 B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶中,并重复操作两次 C.将已冷却的稀硫酸注入经检查不漏水的容量瓶中 D.将浓硫酸沿烧杯内壁缓缓注入盛有蒸馏水的烧杯中,并不断用玻璃棒搅拌 E.继续往容量瓶中小心地滴加蒸馏水,使液面接近瓶颈上的刻度线 F.改用胶头滴管继续向容量瓶中加水至刻线,并摇匀。 (3)配制上述稀硫酸需要用到的玻璃仪器除了量筒、玻璃棒、烧杯、胶头滴管还需要___。 (4)以下操作会导致硫酸浓度有何影响(填“偏低”、“偏高”或“无影响”) a.定容时俯视刻度线___。 b.摇匀后液面下降,继续加水至刻度线___。 |
|
| 22. | 详细信息 |
以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图: (1)本实验中需用到Cl2,请写出实验室制备氯气的离子方程式___。 (2)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。 ①生成Ca(ClO)2的化学方程式为___。 ②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有___(填序号)。 A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解 (3)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O。氯化完成后过滤。 ①滤渣的主要成分为___(填化学式)。 ②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]∶n[CaCl2]___1∶5(填“>”、“<”或“=”)。 (4)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是___。  |
|
| 23. 实验题 | 详细信息 |
|
某Cu(Ⅱ)盐晶体组成可表示为Ka[Cub(C2O4)c]·dH2O,测定其组成的实验如下: (Ⅰ)铜含量的测定。准确称取3.540g样品,加入1mol·L-1H2SO4溶解,配制成100mL溶液。取所配溶液25.00mL于锥形瓶中,加入过量淀粉-KI溶液,充分反应后,生成的I2恰好与12.50mL0.2000mol·L-1Na2S2O3完全反应。已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O (1)本实验操作中,生成I2的物质的量为___mol,判断生成的I2恰好与Na2S2O3完全反应的现象为___。 (2)3.540g样品中n(Cu2+)=___mol。 (Ⅱ)草酸根含量的测定:取另一份所配溶液25.00mL于锥形瓶中,滴入0.1000mol·L-1KMnO4溶液至恰好完全反应,消耗20.00mLKMnO4溶液。已知:2MnO (3)所配溶液中c(C2O (Ⅲ)计算该铜盐的组成(写出计算过程)___。 |
|
最近更新



