西双版纳傣族自治州勐腊县第一中学高一化学上册期末考试考试完整版
| 1. 选择题 | 详细信息 |
|
下列化合物不可通过单质直接化合生成的为 A. FeCl2 B. Na2O2 C. CuCl2 D. HCl |
|
| 2. 选择题 | 详细信息 |
|
有关过氧化钠与水反应,下列说法错误的是( ) A.产生的气体可以使带火星的木条复燃 B.过氧化钠是氧化剂,水是还原剂 C.反应后的溶液中滴加酚酞后溶液将变红 D.该反应是放热反应 |
|
| 3. 选择题 | 详细信息 |
|
50 mL 0.6 mol·L-1氢氧化钠溶液,含氢氧化钠的物质的量为 ( ) A. 0.03 mol B. 0.04 mol C. 0.05 mol D. 0.06 mol |
|
| 4. 选择题 | 详细信息 |
|
下列有关电解质的说法中正确的是 A. 液态氯化氢不导电,所以氯化氢不是电解质 B. 氨溶于水形成的溶液能导电,所以氨是电解质 C. 熔融的铜导电性很好,所以铜是电解质 D. 氧化钠、氧化钙熔融时能导电,所以氧化钠、氧化钙是电解质 |
|
| 5. 选择题 | 详细信息 |
|
既能跟稀硫酸反应又能跟熟石灰反应的物质是( ) A.硫酸铜 B.碳酸钠 C.氢氧化钠 D.碳酸钙 |
|
| 6. 选择题 | 详细信息 |
|
下列现象或应用中,不能用胶体的知识解释的是( ) A. 在饱和氯化铁溶液中逐滴加入氢氧化钠溶液,产生红褐色沉淀 B. 用微波手术刀进行外科手术,可使开刀处的血液凝固而减少失血 C. 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 D. 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
|
| 7. 选择题 | 详细信息 |
|
下列原子结构示意图所表示的元素与 A. |
|
| 8. 选择题 | 详细信息 |
|
用“物质的量的单位——摩尔”计量的对象是( ) A. 商场货品(如文具等) B. 细小物品(如米粒等) C. 微观粒子(如分子等) D. 只有分子、原子和离子 |
|
| 9. 选择题 | 详细信息 |
|
按照物质的分类方法,硝酸应属于( ) ①酸、②氢化物、③氧化物、④含氧酸、⑤难挥发性酸、⑥一元酸、⑦化合物、⑧混合物。 A.①②③④⑤⑥⑦⑧ B.①④⑥⑦ C.①⑨ D.①④⑤⑥⑦ |
|
| 10. 选择题 | 详细信息 |
|
下列物质中均为既含有离子键又含有共价键的一组是( ) A.NaOH、H2O、NH4Cl B.KOH、Na2O2、(NH4)2S C.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2 |
|
| 11. 选择题 | 详细信息 |
|
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3的作用是( ) A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂 |
|
| 12. 选择题 | 详细信息 |
|
在酸性条件下,可发生如下反应:ClO3— + 2M3++ 4H2O = M2O7n— + Cl— + 8H+,M2O7n— 中M的化合价是 A. +4 B. +5 C. +6 D. +7 |
|
| 13. 选择题 | 详细信息 |
|
某同学制得的氢氧化铁胶体中含有少量盐酸,为得到纯净的胶体,他设计了以下操作,合理的是( ) A.加入少量氢氧化钠溶液进行中和 B.加入硝酸银溶液反应后过滤 C.装入半透膜袋中,扎紧袋口,将其全部浸入蒸馏水中,并每隔一段时间,更换一次蒸馏水 D.在氢氧化铁胶体中插入石墨电极,通入直流电进行电泳后再过滤 |
|
| 14. 选择题 | 详细信息 |
|
下列所述性质中能证明化合物微粒间一定存在离子键的是( ) A.易溶于水 B.具有较高的熔点 C.熔融状态下能导电 D.溶于水能电离出离子 |
|
| 15. 选择题 | 详细信息 |
|
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O,关于该反应的下列说法正确的是( ) A.NaNO2是氧化剂 B.每生成1mol N2时,转移电子的物质的量为6mol C.NH4Cl中的氮元素被还原 D.N2既是氧化剂,又是还原剂 |
|
| 16. 选择题 | 详细信息 |
|
下列关于物质性质变化的比较,不正确的是 A. 离子半径大小S2->O2->Na+ B. 气态氢化物稳定性: HBr < HCl < HF C. 碱性强弱: KOH>NaOH>LiOH D. 还原性强弱: F->Cl->Br->I- |
|
| 17. 选择题 | 详细信息 |
|
在氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列实验现象和结论一致且正确的是 ( ) A.加入有色布条,有色布条褪色,说明原溶液中有Cl2存在 B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 C.加入盐酸酸化的AgNO3溶液产生白色沉淀,说明原溶液中有Cl-存在 D.加入NaOH溶液,氯水黄绿色消失,说明原溶液中有HClO分子存在 |
|
| 18. 选择题 | 详细信息 |
|
含有极性键且分子中各原子都满足8电子稳定结构的化合物是( ) A.CH4 B.NaCl C.CO2 D.N2 |
|
| 19. 选择题 | 详细信息 |
|
据科学家预测,月球的土壤中吸附着百万吨的氦(He3),其原子核中质子数为2、中子数为1。下列关于氦(He3)元素的说法正确的是( ) A.原子核外电子数为3 B.相对原子质量为2 C.原子结构示意图为 |
|
| 20. 选择题 | 详细信息 |
|
已知氢氧化铁胶体和碘化银胶体混合后,出现了氢氧化铁沉淀和碘化银沉淀,则下列说法中不正确的是( ) ①碘化银胶体中的胶粒与氢氧化铁胶体中的胶粒所带电荷相反 ②该实验说明了这两种胶体是带电的 ③在这两种胶体中分别加入蔗糖也可以生成沉淀 ④生成的沉淀不能透过滤纸 A.①和② B.②和③ C.③和④ D.①和④ |
|
| 21. 选择题 | 详细信息 |
|
下列反应属于同种物质中同一价态的同一元素部分被氧化,部分被还原的氧化还原反应的是( ) A.3Br2+6KOH B.MnO2+4HCl(浓) C.2KNO3 D.NH4NO3 |
|
| 22. 选择题 | 详细信息 |
下列各图中能较长时间看到氢氧化亚铁白色沉淀的是( )  A. ①②③④⑤ B. ①②⑤ C. ①②③④ D. ②④⑤ |
|
| 23. 选择题 | 详细信息 |
|
下列各组中两个溶液间的反应,均可用同一离子方程式表示的是 ( ) A.CH3COOH和Na2CO3与CH3COOH和NaHCO3 B.AgNO3和HCl与Ag2SO4和HCl C.BaCl2和Na2SO4 与Ba(OH)2与H2SO4 D.KOH和CH3COONH4与Ba(OH)2与NH4Cl |
|
| 24. 选择题 | 详细信息 |
|
下列诗句描述的过程涉及氧化还原反应的是( ) A.月波成露露成霜 B.雪融山顶响流泉 C.粉身碎骨浑不怕 D.爆竹声中一岁除 |
|
| 25. 填空题 | 详细信息 |
|
氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题: (1)砷在元素周期表中的位置______。 已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________。 (2)氮和磷氢化物性质的比较:热稳定性:NH3________PH3(填“>”或“<”)。沸点:N2H4________P2H4(填“>”或“<”),判断依据是____________。 |
|
| 26. 实验题 | 详细信息 |
某学习小组的同学对氯气与铁的反应及产物进行了如下探究: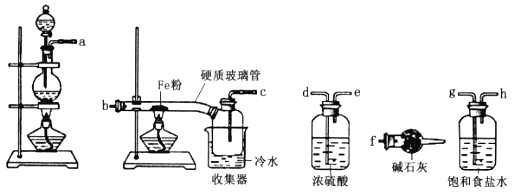 (1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________ (2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。 (3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:  试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。 A.Fe和FeCl3 B.FeCl2 和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2 (4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。 (5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字) |
|
| 27. 推断题 | 详细信息 |
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)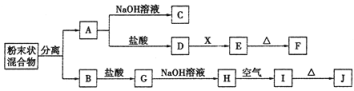 (1)写出下列物质的化学式:F____________,G________________。 (2)将混合物中两种金属分离开的最简单的方法是___________。 (3)D→E的转化中,加入过量的X可能是_____________________。 A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液 (4)写出下列转化的化学方程式: A→C:______________________________________________; H→I:_______________________________________________。 |
|
| 28. 实验题 | 详细信息 |
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下: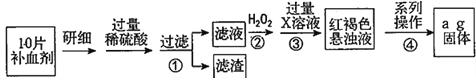 请回答下列问题: (1)向操作①的滤液中滴加KSCN 溶液后变为红色,则该滤液中含有______(填离子符号)。 (2)操作②中反应的离子方程式:__________________________________。 (3)操作③中反应的离子方程式:__________________________________。 (4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。 (5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示) |
|
| 29. 推断题 | 详细信息 |
|
有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。 (1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。 (2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。 (3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。 |
|
| 30. 推断题 | 详细信息 |
A~G各物质间的关系如图,其中B、D为气态单质。 请回答下列问题。 (1)物质C和E的名称分别为_______、_______; (2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______; (3)MnO2在反应①和反应②中的作用分别是_______、_______; (4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。 |
|
最近更新



