西安市2018年高二化学上册期中考试在线答题
| 1. 选择题 | 详细信息 |
|
化学与生活和化工、能源、材料生产密切相关,下列有关说法不正确的是 A. 吸水性高分子、医用生物高分子、导电高分子均属于功能高分子材料 B. 通过干馏,可以将煤中含有的苯等芳香烃从煤中分离出来 C. 太阳能、生物质能、风能、氢能均属于新能源 D. 用灼烧的方法可以区分蚕丝和涤纶 |
|
| 2. 选择题 | 详细信息 |
|
EPA、DHA均为不饱和羧酸,是鱼油的水解产物之一,1mol分子式为C67H96O6的鱼油完全水解后,生成1mol甘油(C3H8O3)、1mol EPA和2mol DHA,EPA、DHA的分子式分别为 A. C20H30O2、C22H32O2 B. C22H32O2、C20H30O2 C. C22H30O2、C20H30O2 D. C20H30O2、C22H30O2 |
|
| 3. 选择题 | 详细信息 |
|
将固体NH4Br置于2.0 L的密闭容器中,在某温度下发生如下反应: NH4Br(s) 2HBr(g) 2 min后,测得H2为1 mol,HBr为8 mol,则上述反应中生成NH3的速率为( ) A. 0.5 mol·(L·min)-1 B. 2 mol·(L·min)-1 C. 2.5 mol·(L·min)-1 D. 5 mol·(L·min)-1 |
|
| 4. 选择题 | 详细信息 |
|
则下列说法正确的是( ) A. B. A的结构简式是CH2=CHCH2CH3 C. A能使高锰酸钾酸性溶液褪色 D. ①、②、③的反应类型分别为卤代、水解、消去 |
|
| 5. 选择题 | 详细信息 | |||||||||||||||
根据下列实验操作和现象所得出的结论正确的是
|
||||||||||||||||
| 6. 选择题 | 详细信息 | ||||||||||||||
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
|
|||||||||||||||
| 7. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 正丁醇、正丁烷、2-甲基丙烷、丙烷的沸点逐渐降低 B. 互为同系物的有机物随碳原子数递增,等质量完全燃烧耗氧量增加 C. 酯A的分子式为C9H18O2,酸性条件下A水解生成对分子质量相同的两种有机物。则A的可能结构最多有16种(不考虑立体异构,下同) D. 分子式为C8H11N的有机物,分子内含有苯环和氨基(-NH2)的同分异构体数目为14种 |
|
| 8. 选择题 | 详细信息 |
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下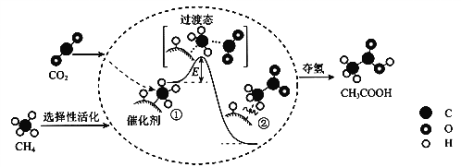 下列说法正确的是 A. 生成CH3COOH总反应的原子利用率小于100% B. CH4+CO2→CH3COOH过程中,CH4分子中所有C―H键发生断裂 C. ①→②放出能量并形成了C―C键 D. 该催化剂可有效改变该反应的反应热 |
|
| 9. 选择题 | 详细信息 |
|
下列热化学方程式或叙述正确的是 A. 已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1 B. 500℃、30 MPa下,N2(g)+3H2(g) C. 已知氢气的燃烧热为286 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+572 kJ·mol-1 D. 甲烷的燃烧热为890.3 kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 |
|
| 10. 选择题 | 详细信息 |
Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是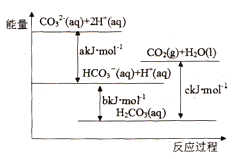 A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应 B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol |
|
| 11. 选择题 | 详细信息 |
|
称取三份锌粉,分别盛于甲、乙、丙三支试管中。甲中加入50mLc(H+)=0.1mol/L的盐酸,乙中加入50mL c(H+)=0.1mol/L的醋酸,丙加入50mLc(H+)=0.1mol/L的醋酸及少量的胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌,则下列说法不正确的是 A. 开始时反应速率的大小:甲=乙=丙 B. 反应终了时,所需时间的大小:甲>乙>丙 C. 反应过程中,甲、乙速率相同 D. 三支试管中参加反应的锌的质量:甲=乙<丙 |
|
| 12. 选择题 | 详细信息 |
|
将4 mol A 气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g) ①2s内,用物质A表示的反应的平均速率为0.6 mol·L-1·s-1; ②2s末,体系中混合气体的压强是起始的0.9倍; ③2 s末,物质A的转化率为30 %; ④2 s末,物质C的体积分数约为22.2%。 ⑤2s内,分别用A、B、C表示的反应速率其比值是14:7:6 其中正确的是 A. ①④⑤ B. ②③④ C. ①③④ D. ③④⑤ |
|
| 13. 选择题 | 详细信息 |
|
已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解分为两步: ①2KClO3+4MnO2 ②2Mn2O7 下列有关说法不正确的是 A. 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 B. 1 g KClO3 ,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量仍为1 g C. KClO3分解速率快慢主要取决于反应① D. 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
|
| 14. 选择题 | 详细信息 |
|
煤燃烧过程中加入石灰石可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。发生的两个相关反应的热化学方程式如下: 反应Ⅰ:CaSO4(s)+CO(g) 反应Ⅱ:CaSO4(s)+4CO(g) 已知:①反应Ⅰ和反应Ⅱ同时发生 ②反应Ⅰ的速率大于反应Ⅱ的速率 下列反应过程能量变化示意图正确的是 A. 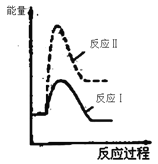 B. B.  C. C. 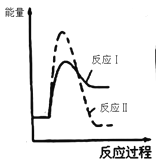 D. D.  |
|
| 15. 选择题 | 详细信息 |
|
一定量的盐酸跟过量的铁粉反应,为了减缓反应速度且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥ KCl溶液. A. ②④⑥ B. ①② C. ②③⑤ D. ②④⑤⑥ |
|
| 16. 选择题 | 详细信息 |
一定温度下,向容积为2 L的密闭容器中通入气体X、Y、Z,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是 A. 该反应的化学方程式为2X+Y B. 反应开始至2min时,Z的平均反应速率为0.1 mol·L-1·min-1 C. 该反应为可逆反应 D. 4min时,X、Z的速率相等 |
|
| 17. 选择题 | 详细信息 |
|
反应A(g)+3B(g) A. v(D)=0.5 mol·L-1·s-1 B. v(C)=0.8 mol·L-1·s-1 C. v(B)=0.9 mol·L-1·s-1 D. v(A)=0.3 mol·L-1·s-1 |
|
| 18. 选择题 | 详细信息 |
|
短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 的简单氢化物可用作制冷剂, Y 的原子半径是所有短周期主族元素中最大的。由 X、Y 和 Z 三种元素形成的一种盐A溶于水后,加入稀硫酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是 A. 因为H-X的键能大于H-W的键能,所以简单氢化物的热稳定性前者弱与后者 B. Y 的简单离子与 X 的简单离子具有相同的电子层结构 C. A溶液与稀硫酸溶液反应,随温度升反应速率加快 D. 1molZ的最高价氧化物的水化物与足量的氢氧化钠溶液反应放出热量为57.3kJ |
|
| 19. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 增大压强,活化分子数增多,化学反应速率一定增大 B. 升高温度,活化分子百分数不一定增大,化学反应速率一定增大 C. 活化分子间所发生的分子间的碰撞为有效碰撞 D. 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
|
| 20. 实验题 | 详细信息 | ||||||||||||||||||||||||||||
完成下列问题 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
|
|||||||||||||||||||||||||||||
| 21. 实验题 | 详细信息 |
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理: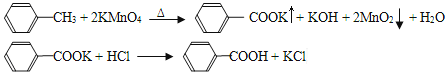 己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。 i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。 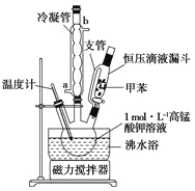 (1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。 (2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。 A. 50mL B. I00mL C. 200mL D. 250mL 相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。 ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯  (3)操作Ⅰ的名称是___________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________。 iii纯度测定 (4)称取1.220g产品,配成100mL甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应)。重复三次,平均每次消耗KOH溶液的体积24.00mL。样品中苯甲酸纯度为______________。 (5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,应采用___________法对样品提纯。 |
|
| 22. 实验题 | 详细信息 | ||||||||||||||||||||||||
I “碘钟”实验中,3I-+S2O82-===I3—+2SO42-的反应速率可以用
|
|||||||||||||||||||||||||
| 23. 综合题 | 详细信息 | |||||||||||||||
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: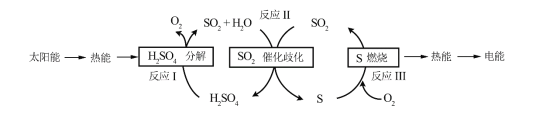 (1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1 反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1 反应Ⅱ的热化学方程式:________________________________。 (2)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。 i.SO2+4I-+4H+=S↓+2I2+2H2O ii.I2+2H2O+_________=_________+_______+2 I-_____________ (3)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
|
||||||||||||||||
| 24. 实验题 | 详细信息 | |||||||||||||||||||
某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题: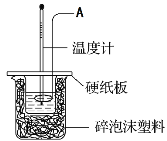 (1)仪器A的名称__________________________ (2)实验过程中下列操作正确是______________(填字母)。 A.用温度计小心搅拌 B.分多次加入氢氧化钠溶液 C.只进行一次实验,用所获得的数据计算中和热 D.用套在温度计上的A轻轻地上下搅动 (3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
|
||||||||||||||||||||




