河南省长垣市第十中学2020-2021年高二上册第二次月考化学题免费试卷
| 1. 选择题 | 详细信息 |
|
下列事实中,不能用勒夏特列原理解释的是( ) A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化 C.实验室中常用排饱和食盐水的方法收集Cl2 D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
|
| 2. 选择题 | 详细信息 |
|
下列说法中正确的是 A.0.1mol/L HCl 和 0.1mol/L H2SO4 与 2 mol/L NaOH 溶液反应速率相同 B.0.1mol/L HCl 和 0.1mol/L HNO3 与相同形状和大小的大理石反应,速率相同 C.Mg、Al 在相同条件下分别与 0.1mol/L 盐酸反应,其反应速率相同 D.大理石块与大理石粉分别同 0.1mol/L 盐酸反应速率相同 |
|
| 3. 选择题 | 详细信息 |
|
已知热化学方程式:H2O(g)=H2(g) + A.吸热88 kJ B.吸热2.44 kJ C.放热44 kJ D.吸热44 kJ |
|
| 4. 选择题 | 详细信息 |
|
已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( ) A. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 D. 2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量 |
|
| 5. 选择题 | 详细信息 |
|
某温度下反应H2(g)+I2(g) A.反应正好达到平衡 B.反应向左进行 C.反应向某方向进行一段时间后K<57.0 D.反应向某方向进行一段时间后c(H2)<0.2mol·L−1 |
|
| 6. 选择题 | 详细信息 |
|
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol②稀溶液中,H++OHˉ=H2O(l);ΔH=-57.3kJ/mol下列结论正确的是 A.碳的燃烧热大于110.5kJ/mol B.①的反应热为221kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
|
| 7. 选择题 | 详细信息 |
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。图M-1表示该反应进行过程中能量的变化。关于该反应的下列说法中,正确的是( ) A.ΔH>0, ΔS>0 B.ΔH>0,ΔS<0 C.ΔH<0, ΔS<0 D.ΔH<0,ΔS>0 |
|
| 8. 选择题 | 详细信息 |
|
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H =-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是() A. △H1>△H2>△H3 B. △H1<△H2<△H3 C. △H1>△H2=△H3 D. △H1=△H2<△H3 |
|
| 9. 选择题 | 详细信息 |
I2在KI溶液中存在下列平衡:I2(aq) + I-(aq) 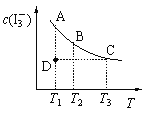 A.反应 I2(aq) + I-(aq) B.状态A与状态B相比,状态A的c(I2)大 C.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 D.若反应进行到状态D时,一定有v正>v逆 |
|
| 10. 选择题 | 详细信息 |
|
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0kJ·mol-1 ②CH3OH(g)+ 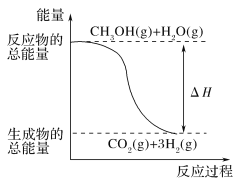 下列说法正确的是( ) A.CH3OH的燃烧热为192.9kJ∙mol-1 B.反应①中的能量变化如图所示 C.CH3OH转变成H2的过程一定要吸收能量 D.根据②推知反应CH3OH(l)+ |
|
| 11. 选择题 | 详细信息 |
|
根据以下三个热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1 2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1 2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1 判断Q1、Q2、Q3三者关系正确的是 A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3 |
|
| 12. 选择题 | 详细信息 |
|
恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s) ①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2. A. ⑤⑥⑧ B. ②⑤⑧ C. ①③④ D. ②④⑦ |
|
| 13. 选择题 | 详细信息 | ||||||||||||
某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
A.该温度下,此反应的平衡常数K=6.75 |
|||||||||||||
| 14. 选择题 | 详细信息 |
在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)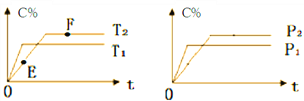 A. E点的v(逆)大于F点的v(正) B. 若在F点时给容器加压,达新平衡时C的浓度将增大 C. 若给容器加热,该反应的平衡常数K将增大 D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变 |
|
| 15. 选择题 | 详细信息 |
|
在一定条件下发生反应3A(g)+2B(g) A.z=4 B.B的转化率是40% C.A的平衡浓度是1.4 mol·L–1 D.平衡时气体压强是原来的1.2倍 |
|
| 16. 选择题 | 详细信息 |
|
已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+1/2O2(g)===CO(g) ΔH=Q中Q等于( ) A. -(5a-0.5b) kJ·mol-1 B. -(a-b) kJ·mol-1 C. -(a+b) kJ·mol-1 D. -(10a-b) kJ·mol-1 |
|
| 17. 计算题 | 详细信息 |
|
在一定条件下,可逆反应A2(g)+B2(g)⇌2C(g)达到平衡时,A2、B2和C的浓度分别为0.5 mol/L、0.1mol/L、1.6 mol/L,若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则: (1)a、b应满足的关系是___________。 (2)a的取值范围是___________。 |
|
| 18. 填空题 | 详细信息 |
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。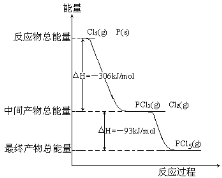 根据上图回答下列问题: (1)P和Cl2反应生成PCl3的热化学方程式___。 (2)PCl5分解成PCl3和Cl2的热化学方程式___。 (3)P和Cl2分两步反应生成1molPCl5的△H3=__,P和Cl2一步反应生成1molPCl5的△H4___△H3 (填“大于”、“小于”或“等于”)。 (4)PCl5与足量水充分反应,最终生成两种酸,已知反应前后各元素化合价不变,其化学方程式是__。 |
|
| 19. 实验题 | 详细信息 |
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: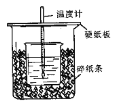 (1)从实验装置上看,图中尚缺少的一种玻璃用品是________。 (2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大、偏小、无影响”) (3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热________(填“相等、不相等”),所求中和热_______(填“相等、不相等”),简述理由_______ (4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______。(填“偏大”、“偏小”、“无影响”) |
|
| 20. | 详细信息 |
|
汽车在行驶过程中有如下反应发生: ⅰ.N2(g)+O2(g) ⇌2NO(g)ΔH=+180.7 kJ·mol-1 ⅱ.2NO(g)+2CO(g) ⇌N2(g)+2CO2(g)ΔH=-746.5 kJ·mol-1 (1)能表示CO燃烧热的热化学方程式为___________。 (2)反应ⅱ在___________(填“较高”或“较低”)温度下能自发进行。 (3)T温度时,向10 L恒容密闭容器中充入2 molNO和2molCO发生反应ⅱ,5min时达到平衡,测得0~5min内该反应速率v(N2)=0.016 mol·L-1·min-1 ①T温度时,该反应的平衡常数K=___________。 ②平衡时容器内压强与起始时容器内压强之比为___________。 (4)一定条件下,向起始容积为5 L的恒压密闭容器中充入1 mol N2和1 mol O2发生反应ⅰ。O2的平衡转化率[α(O2)]与温度(T)的关系如图1所示;正反应的平衡常数(K正)与温度(T)的关系如图2所示。  ①图1中,M、N、P三点所对应的状态下,v正>v逆的是___________(填字母),理由为___________。 ②T1温度时,K正=1,则O2的平衡转化率为___________(保留三位有效数字)。 |
|
| 21. | 详细信息 | ||||||||
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O⇌2NH3+
请回答下列问题: |
|||||||||
最近更新




