黑龙江2019年高二化学下半期月考测验试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
下列各能层不包含d能级的是 ( ) A. O能层 B. N能层 C. M能层 D. K能层 |
|
| 2. 选择题 | 详细信息 |
|
下列关于晶体的说法正确的是 ( ) A. 在晶体中只要有阳离子就一定有阴离子 B. 分子晶体的熔点不一定比金属晶体的低 C. 原子晶体的熔点一定比金属晶体的高 D. 离子晶体一定溶于水 |
|
| 3. 选择题 | 详细信息 |
|
下列微粒:①CH4②NH3③CH3C00 -④NH4+⑤H20 中含有配位键的是 A. ①② B. ①③ C. ④⑤ D. ②④ |
|
| 4. 选择题 | 详细信息 |
|
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键的夹角为120°,它能水解,有关叙述正确的是( ) A. 氯化硼液态时能导电而固态时不导电 B. 氯化硼中心原子采用sp杂化 C. 氯化硼分子呈正三角形,属非极性分子 D. 三氯化硼遇水蒸气不会产生白雾 |
|
| 5. 选择题 | 详细信息 |
|
下列物质中,化学式能准确表示该物质分子组成的是( ) A. NH4Cl B. SiO2 C. P4 D. Na2SO4 |
|
| 6. 选择题 | 详细信息 |
|
以下对于化学键的理解中,正确的是( ) A. 化学键是分子(或晶体)内相邻的两个或多个原子(或离子)之间强烈的作用力 B. 化学键存在于任何分子内 C. 化学键只存在于离子化合物和共价化合物中 D. 氢键和范德华力也是一种化学键 |
|
| 7. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 离子晶体不一定都含有金属元素 B. 离子晶体中除含离子键外,还可能含有其他化学键 C. 金属元素与非金属元素构成的晶体不一定是离子晶体 D. 熔化后能导电的晶体一定是离子晶体 |
|
| 8. 选择题 | 详细信息 |
|
甲、乙是周期表中同一主族两种元素,若甲的原子序数为x,则乙的原子序数不可能( ) A. x+10 B. x+12 C. x+16 D. x+50 |
|
| 9. 选择题 | 详细信息 |
|
下列原子半径大小顺序正确的是( ) ①1s22s22p3 ②1s22s22p63s23p3③1s22s22p5 ④1s22s22p63s23p2 A. ③>④>②>① B. ④>③>②>① C. ④>③>①>② D. ④>②>①>③ |
|
| 10. 选择题 | 详细信息 |
|
最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构。下列对该晶体叙述正确的是( ) A. 该晶体类型是分子晶体 B. 该晶体的空间最小环共有六个原子构成 C. 晶体中碳原子数与C―O键数之比为1∶2 D. 该晶体中碳原子和氧原子的个数比为1∶2 |
|
| 11. 选择题 | 详细信息 |
|
下列过程属于物理变化的是( ) A. 石油裂化 B. 乙烯聚合 C. 煤的干馏 D. 石油分馏 |
|
| 12. 选择题 | 详细信息 |
|
下列说法正确的是 A. HCl属于共价化合物,溶于水能电离出H+和Cl- B. NaOH是离子化合物,该物质中只含离子键 C. HI气体受热分解的过程中,只需克服分子间作用力 D. 石英和干冰均为原子晶体 |
|
| 13. 选择题 | 详细信息 |
|
下列说法正确的是 ( ) A. π键是由两个p轨道“头碰头”重叠形成的 B. σ键就是单键,π键就是双键 C. 乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键 D. H2分子中含σ键,而Cl2分子中含π键 |
|
| 14. 选择题 | 详细信息 |
|
金属晶体的堆积方式、空间利用率和配位数关系正确的是( ) A. 钋Po——简单立方堆积——52%——6 B. 钠Na——钾型——74%——12 C. 锌Zn——镁型——68%——8 D. 银Ag——铜型——74%——8 |
|
| 15. 选择题 | 详细信息 |
|
下列说法不正确的是 A. CO2、SiO2的晶体结构类型不同 B. 加热硅、硫晶体使之熔化,克服的作用力不同 C. HCl、NaCl溶于水,破坏的化学健类型相同 D. NaOH、NH4Cl晶体中既有离子键又有共价键 |
|
| 16. 选择题 | 详细信息 |
|
预测H2S 和BF3的立体结构,两个结论都正确的是 A. V形;平面三角形 B. V 形;三角锥形 C. 直线形;平面三角形 D. 直线形; 三角锥形 |
|
| 17. 选择题 | 详细信息 |
|
具有下列电子层结构的原子或离子,其对应元素一定属于同一周期的是( ) A. 两原子核外全部都是s电子 B. 最外层电子排布为3s23p6的原子和最外层电子排布为3s23p6的离子 C. 原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子 D. 3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子 |
|
| 18. 选择题 | 详细信息 |
|
能用键能大小解释的是( ) A.稀有气体一般很难发生化学反应 B.常温常压下,氟气的密度小于氯气 C.相同条件下,NH3在水中的溶解度大于PH3 D. SiC晶体的熔点比晶体硅的高 |
|
| 19. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 通常,同周期元素中ⅦA族元素的第一电离能最大 B. 在同一主族中,自上而下元素的第一电离能逐渐减小 C. 第ⅠA、ⅡA族元素的原子,其原子半径越大,第一电离能越大 D. 主族元素的原子形成单原子离子时的最高化合价数都和它的族序数相等 |
|
| 20. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 1s轨道的电子云形状为圆形的面 B. 2s的电子云半径比1s电子云半径大,说明2s能级的电子比1s的多 C. 电子在1s轨道上运动像地球围绕太阳旋转 D. 4f能级中最多可容纳14个电子 |
|
| 21. 选择题 | 详细信息 |
|
X元素的1个原子失去2个电子,被Y元素的2个原子各获得1个电子,形成离子化合物Z,下列说法中不正确的是 ( ) A. 固态Z是离子晶体 B. Z可以表示为X2Y C. 固态Z熔化后能导电 D. X可形成+2价阳离子 |
|
| 22. 选择题 | 详细信息 |
|
某元素的原子核外有三个能层,最外层有4个电子,该原子核内的质子数为 A. 14 B. 15 C. 16 D. 17 |
|
| 23. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 烯烃中的碳碳双键由l个δ键和l个π键组成 B. 2s轨道可以和3p轨道形成sp2杂化轨道 C. 由极性键组成的分子,一定是极性分子 D. 甲烷中sp3杂化轨道的构型是平面正方形 |
|
| 24. 填空题 | 详细信息 |
|
指出下列原子的杂化轨道类型及分子的结构式、空间构型。 (1)CO2分子中的C采取______杂化,分子的结构式为______,空间构型呈______; (2)CH2O中的C采取______杂化,分子的结构式为______,空间构型呈______; (3)H2S分子中的S采取______杂化,分子的结构式为______,空间构型呈______。 |
|
| 25. 综合题 | 详细信息 |
|
2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。 (1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________,金属铜的晶体中,铜原子的堆积方式为___________。 (2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。 (3)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___________。 (4)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,晶胞边长为540pm,则该晶体的密度___________g/cm3(只列式不计算)(1pm=10-10cm)  |
|
| 26. 综合题 | 详细信息 |
|
第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。 (1)砷元素的基态原子价电子排布图为_____________; (2)氮元素的单质除了N2外,还有N4,则N4中的N原子的轨道杂化方式为____________; (3)对氨基苯甲醛与邻氨基苯甲醛相比,沸点较高的是_________(填空“前者”或“后者”),原因是________; (4)王水溶解黄金的反应如下:Au+HNO3+4HCl=H[AuCl4]+NO+2H2O,产物中的H[AuCl4]是配合物,它的配位体是____________,Au元素提供_________; (5)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图,晶胞参数α=565pm。(黑球:Ga, 白球:As) 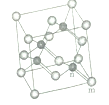 砷化镓的化学式___________,镓原子的配位数为________。 |
|
最近更新



