广南县第三中学2019年高二化学上册开学考试网上考试练习
| 1. 选择题 | 详细信息 |
|
某无色溶液放入铝片后有氢气产生,在该溶液中下列离子一定可以大量存在的是( ) A. HCO C. Cl- D. CO32- |
|
| 2. 选择题 | 详细信息 |
|
根据中学化学教材所附元素周期表判断,下列叙述中正确的是 A. L电子层电子数为奇数的所有元素都是非金属 B. 同一主族的两种元素的原子序数之差可能是16、26、36、46 C. 只有第IIA族元素的原子最外层有2个电子 D. 由左至右第8、9、10 三列元素中没有非金属元素 |
|
| 3. 选择题 | 详细信息 |
|
下列试剂的保存或使用正确的是( ) A. 金属锂保存在煤油中,使用前要用滤纸吸干煤油 B. 过氧化钠比氧化钠稳定,因此过氧化钠可露置在空气中 C. 称量NaOH固体时,应先在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 D. 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物中一定有钾元素 |
|
| 4. 选择题 | 详细信息 |
|
碲(Te)是与O、S同主族的元素,位于第五周期。据此,推断碲的相关性质错误的是 A. 碲的单质在常温下是固态 B. 碲的常见化合价是-2、+4、+6 C. 碲可能作半导体材料 D. 碲的氢化物H2Te很稳定 |
|
| 5. 选择题 | 详细信息 |
|
A、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子分别为A2−、C−,离子半径A2−大于C−,B2+和C−具有相同的电子层结构。下列判断正确的是 A. 原子序数由大到小的顺序是C>A>B B. 原子半径由大到小的顺序是r(B)>r(A)>r(C) C. 离子半径由大到小的顺序是r(C−)>r(B2+)>r(A2−) D. 原子最外层电子数由多到少的顺序是B>A>C |
|
| 6. 选择题 | 详细信息 |
|
用铝热剂冶炼难熔金属,是因为铝( ) ①具有导电性 ②具有较强的还原性 ③具有延展性 ④被氧化过程中放出大量的热。 A. ① B. ①②③ C. ②④ D. ①②③④ |
|
| 7. 选择题 | 详细信息 |
|
下列关于物质分类的叙述错误的是 A. 饱和食盐水属于混合物 B. 碳酸钠既属于钠盐又属于碳酸盐 C. 胆矾属于混合物 D. 纯净物一般可分成单质和化合物两类 |
|
| 8. 选择题 | 详细信息 |
|
实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制: ①蒸馏;②水洗;③用干燥剂干燥;④10% NaOH溶液洗;⑤水洗。 正确的操作顺序是 A. ①②③④⑤ B. ②④⑤③① C. ④②③①⑤ D. ②④①⑤③ |
|
| 9. 选择题 | 详细信息 |
下面是合成氨的简要流程示意图: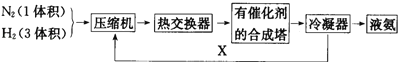 沿X路线回去的物质是( ) A. N2和H2 B. 催化剂 C. N2 D. H2 |
|
| 10. 选择题 | 详细信息 |
|
下列对元素周期表的认识正确的是 A. 有9行7个周期 B. 有16列16个族 C. 有三个短周期四个长周期 D. 非金属元素存在于主族与副族中 |
|
| 11. 选择题 | 详细信息 |
如图是某种有机物分子的球棍模型图,图中的“棍”代表单键或双键,不同大小的“球”代表不同的短周期元素的原子,对该有机物的叙述不正确的是 A. 该有机物可能的化学式为C2HCl3 B. 该有机物可以由乙烯和氯化氢通过加成反应得到 C. 该有机物分子中的所有原子在一个平面上 D. 该有机物分子中一定有碳碳双键 |
|
| 12. 选择题 | 详细信息 |
|
为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是 A. 碳水化合物 B. 碳氢化合物 C. 氢气 D. 乙醇 |
|
| 13. 选择题 | 详细信息 |
|
下列关于实验室用二氧化锰制取氯气的叙述不正确的是 A. 二氧化锰与浓盐酸共热 B. 缓慢加热反应 C. 用向下排空气法收集氯气 D. 多余氯气常用较浓的碱液吸收 |
|
| 14. 选择题 | 详细信息 |
|
科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现Al的超原子结构Al13和Al14,Al13、Al14的性质很像现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法正确的是 A. Al13、Al14互为同位素 B. All4与ⅡA族元素性质相似 C. Al13和Al14都具有强还原性,容易失去电子生成阳离子 D. Al13超原子中Al原子间是通过离子键结合的 |
|
| 15. 选择题 | 详细信息 |
|
同温同压下,两种气体的体积如果不相同,其主要原因是 A. 气体的分子大小不同 B. 气体分子间的平均距离不同 C. 气体的性质不同 D. 气体的分子数不同 |
|
| 16. 选择题 | 详细信息 |
|
氯气的颜色是 A. 无色 B. 白色 C. 红棕色 D. 黄绿色 |
|
| 17. 选择题 | 详细信息 |
一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如右图所示。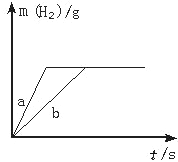 则下列说法正确的是 A. 投入的Na、K一定等质量. B. 投入的Na的质量小于K的质量 C. 曲线a为Na,b为K D. 稀盐酸的量一定是不足量的 |
|
| 18. 选择题 | 详细信息 |
|
能正确表示下列化学反应的离子方程式的是( ) A. 石灰水与盐酸的反应 OH﹣+H+===H2O B. 氧化铜与盐酸反应 O2﹣+2H+===H2O C. 铜片插入硝酸银溶液中 Cu+Ag+===Cu2++Ag D. 碳酸钙溶于醋酸中 CaCO3+2H+===Ca2++H2O+CO2↑ |
|
| 19. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是 ( ) A. Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+ H2O B. 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O C. 向100mL 1mol/L FeBr2溶液中通入0. 5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- D. 氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+ 3H+=Fe3++ 3H2O |
|
| 20. 选择题 | 详细信息 |
|
为了确定某物质是否变质,所选试剂(括号内物质)错误的是 A. Na2SO3是否被氧化(BaCl2) B. FeCl2是否被氧化(KSCN) C. KI是否被氧化(淀粉溶液) D. 氯水是否失效(pH试纸) |
|
| 21. 选择题 | 详细信息 |
|
VL硫酸钾溶液中含有mg钾离子,则溶液中硫酸根离子的物质的量浓度 A. |
|
| 22. 选择题 | 详细信息 |
|
下列说法正确的是 A. 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 B. 古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 C. 氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度 D. 化学变化是指有新物质生成的变化,因此裂化、炭化属于化学变化,风化、老化则属于物理变化。 |
|
| 23. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L B. 25 ℃,1.01×105Pa,64gSO2中含有的原子数为3NA C. 在常温常压下,11.2LCl2含有的分子数为0.5NA D. 标准状况下,11.2LH2O含有的分子数为0.5NA |
|
| 24. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 B. 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 C. 棉花、羊毛、木材和草类的主要成分都是纤维素 D. 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
|
| 25. 选择题 | 详细信息 |
|
下列有关环境保护的说法中错误的是: A 含氮、磷化合物的生活污水大量排放可使水体富营养化 B 各国工业大量排放二氧化硫是全球气候变暖的主要原因 C 劣质装修材料中的甲醛、苯、氡气等对人体有害 D 废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染 |
|
| 26. 选择题 | 详细信息 |
|
氢氧化钠固体易吸收空气中的二氧化碳而变质。取4.65 g已部分变质的氢氧化钠固体与36.5 g 10%的盐酸恰好完全反应后,将溶液蒸干,所得固体的质量是( ) A. 11.7 g B. 5.85 g C. 4.65 g D. 8.3 g |
|
| 27. 选择题 | 详细信息 |
|
已知3.2 g某气体中含有3.01×1022个分子,此气体的摩尔质量是 A. 16 g·mol-1 B. 32 g·mol-1 C. 64 g·mol-1 D. 80 g·mol-1 |
|
| 28. 选择题 | 详细信息 |
|
以下有关氨及铵盐的叙述中,不正确的是( ) A. 铵态氮肥不能与碱性物质如草木灰混合施用 B. 氨的喷泉实验体现了氨的溶解性和氧化性 C. 实验室里常用固体氯化铵与氢氧化钙反应制取少量氨气 D. 氨具有还原性,一定条件下可与氧化性的物质如氧气发生反应 |
|
| 29. 选择题 | 详细信息 |
|
二氧化硅广泛存在于自然界中,二氧化硅属于 A. 电解质 B. 碱性氧化物 C. 酸性氧化物 D. 两性氧化物 |
|
| 30. 选择题 | 详细信息 |
|
下列有关NaClO和NaCl混合溶液的叙述正确的是 A. 该溶液中,H+、NH4+、Ag+可以大量共存 B. 向该溶液中通入CO2,不发生化学反应 C. 该溶液可作游泳池及环境的消毒剂,有效成分是NaCl D. 常温下,将氯气通入NaOH溶液中可以得到该溶液 |
|
| 31. 实验题 | 详细信息 |
蒸馏是实验室制备蒸馏水的常用方法。 (1)如图是实验室制取蒸馏水的常用装置,图中明显的一个错误是__________________________。 (2)仪器A的名称是____________________,仪器B的名称是____________________________。 (3)实验时A中除加入少量自来水外,还需加入几粒______________ ,其作用是防止液体暴沸。 (4)从锥形瓶取少量收集到的液体于试管中,然后滴入___________________和 _______________(填试剂的化学式),检验是否存在Cl-。 (5)如图装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与上图完全相同。该装置中使用的玻璃导管较长,其作用是______________________________;为了提高冷凝效果,烧杯中最好盛有的物质是 ___________(填名称)。 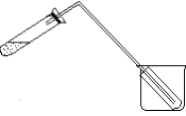 |
|
| 32. 综合题 | 详细信息 |
钠、钾与水反应的实验如下图所示: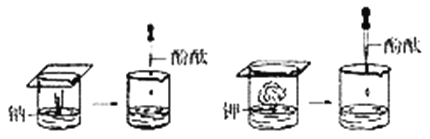 (1)钠、钾与水反应两个实验现象的相同点: ①金属________水面上; ②金属________成闪亮的小球; ③小球四处游动; ④产生嘶嘶的声音; ⑤反应后的溶液使酚酞________。 (2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。 (3)实验结论:________更易与水反应,且反应更_____________________________________。 (4)钾与水反应的化学方程式是___________________________________________________。 |
|
| 33. 实验题 | 详细信息 |
|
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中碳酸钠的质量分数。 [方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。 (1)坩埚中发生反应的化学方程式为____________。 (2)实验中,需加热至恒重的目的是_____________。 [方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量氢氧化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-=BaCO3↓+H2O)。 (1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为__________。 (2)实验中判断沉淀是否完全的方法是__________。 [方案三]按如下图所示装置进行实验:  (1)D装置的作用是________,分液漏斗中_____(填“能”或“不能”)用盐酸代替稀硫酸进行实验。 (2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中碳酸钠的质量分数为________。 (3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是_________。 |
|
| 34. 综合题 | 详细信息 |
已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2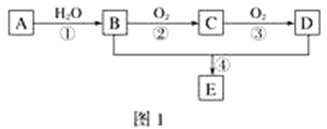 (1)写出下列物质的官能团名称:B:____________________;D:____________________。 (2)反应④的化学方程式为________________________________________________,反应类型:________。 (3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。 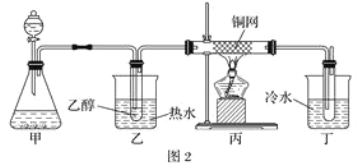 ①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。 A.Na2O2 B.KClC.Na2CO3 D.MnO2 ②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。 ③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。 |
|
| 35. 推断题 | 详细信息 |
A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质。它们之间有如下转化关系: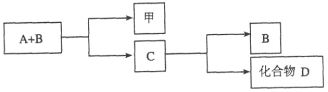 化合物D也是生活中常见的化合物,在一定条件下可发生如下反应:D+3甲 请回答下列问题: (1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。 (2)在常温下,A和B通过__________转化为C。该过程的能量转化关系如何? ____________________。 (3)写出由C生成D的反应的化学方程式____________________。 (4)化合物C是人类生命活动不可缺少的物质之一,它在血液中的正常含量是__________。 (5)目前化合物B在大气中含量呈上升趋势,对环境造成的影响是____________________。 |
|
最近更新



