2019-2020年高二上学期期中考试化学题带答案和解析(吉林省长春市第151中学)
| 1. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量 B. 任何放热反应在常温条件一定能发生反应 C. 原电池反应一定是氧化还原反应 D. 元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
|
| 2. 选择题 | 详细信息 |
|
在同温同压下,下列各组热化学方程式中,ΔH1>ΔH2的是 A. 2H2(g)+O2(g)=2H2O(l)ΔH12H2(g)+O2(g)=2H2O(g)ΔH2 B. S(g)+O2(g)=SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 C. C(s)+1/2O2(g)=CO(g)ΔH1C(s)+O2(g)=CO2(g)ΔH2 D. H2(g)+Cl2(g)=2HCl(g)ΔH11/2H2(g)+1/2Cl2(g)=HCl(g)ΔH2 |
|
| 3. 选择题 | 详细信息 |
|
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动 C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大 |
|
| 4. 选择题 | 详细信息 |
某化学研究小组探究外界条件对化学反应mA(g)+nB(g) A. 由图a可知,T1>T2,该反应的逆反应为吸热反应 B. 由图b可知,该反应m+n<p C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热 D. 图d中,若m+n=p,则曲线a一定增大了压强 |
|
| 5. 选择题 | 详细信息 |
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) 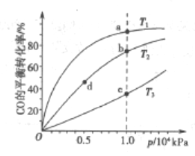 A. 温度:T1>T2>T3 B. 正反应速率:v(a)>v(c), v(b)>v(d) C. 平衡常数:K(a)>K(c),K(b)=K(d) D. 平均摩尔质量:M(a)<M(c),M(b)<M(d) |
|
| 6. 选择题 | 详细信息 |
|
下列有关“化学与生活”的叙述不正确的是 A.凡含有食品添加剂的食物对人体健康均有害 B.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 C.施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用 D.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
|
| 7. 选择题 | 详细信息 |
|
下列微粒中不能破坏水的电离平衡的是( ) A. H+ B. OH- C. S2- D. Na+ |
|
| 8. 选择题 | 详细信息 |
|
在25℃、100 kPa时,已知: ①2H2O(g) = O2(g)+2H2(g) ΔH1 ②Cl2(g)+H2(g) = 2HCl(g) ΔH2 ③2Cl2(g)+2H2O(g) = 4HCl(g)+O2(g) ΔH3 则ΔH3与ΔH1、ΔH2间的关系正确的是 ( ) A.ΔH3 = ΔH1+2ΔH2 B.ΔH3 = ΔH1+ΔH2 C.ΔH3 = ΔH1—2ΔH2 D.ΔH3 = ΔH1—ΔH2 |
|
| 9. 选择题 | 详细信息 |
在恒容密闭容器中通入X并发生反应2X(g) A. M点的正反应速率v正大于N点的逆反应速率v逆 B. T2下在0—t1min时间内v(Y)=a-b/t1mol·L-1·min-1 C. 该反应进行到M点放出的热量大于进行到W点放出的热量 D. M点时再加入一定量X,平衡后X的转化率减小 |
|
| 10. 选择题 | 详细信息 |
在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) A. 该温度下此反应的平衡常数K=3.2 B. 从反应开始到t1时的平均反应速率v(X)=0.2/t1 mol·L-1·min-1 C. 欲提高平衡体系中Y的百分含量,可加入一定量的X D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少 |
|
| 11. 选择题 | 详细信息 |
已知某化学反应的平衡常数表达式为K=c(CO2) c(H2)/(CO) c(H2O),在不同的温度下该反应的平衡常数值分别为: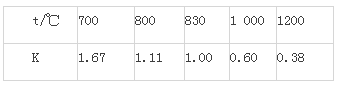 下列有关叙述不正确的是( ) A. 该反应的化学方程式是CO(g)+H2O(g) B. 上述反应的正反应是放热反应 C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态 D. 某温度下,如果平衡浓度符合下列关系式: c(CO2)/3(CO)=c(H2O)/5 c(H2),判断此时的温度1000℃ |
|
| 12. 选择题 | 详细信息 | ||||||||||||||||
在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)
|
|||||||||||||||||
| 13. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 尽管BaSO4难溶于水,但它仍然是强电解质 B. 溶于水后能电离出氢离子的化合物都是酸 C. NaCl溶液在电流的作用下电离为钠离子和氯离子 D. 二氧化碳溶于水后能部分电离,所以二氧化碳是弱电解质 |
|
| 14. 选择题 | 详细信息 |
|
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH A.加少量烧碱 B.降低温度 C.加少量冰醋酸 D.加水 |
|
| 15. 选择题 | 详细信息 |
|
相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是 A. pH相等的两溶液中:c(CH3COOˉ)=c(Clˉ) B. 分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同 C. 相同浓度的两溶液,分别与金属镁反应,反应速率相同 D. 相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COOˉ)=c(Clˉ) |
|
| 16. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||
下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是( )
|
|||||||||||||||||||||||||||||||
| 17. 选择题 | 详细信息 |
|
下列图示与对应的叙述相符的是( ) A.  表示向NH3·H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化 表示向NH3·H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化B. 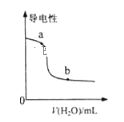 表示向NH3·H2O溶液中加水时溶液的导电性变化,则NH3·H2O溶液的pH:b>a 表示向NH3·H2O溶液中加水时溶液的导电性变化,则NH3·H2O溶液的pH:b>aC.  表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g) 表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g)D.  表示催化剂能改变化学反应的焓变 表示催化剂能改变化学反应的焓变 |
|
| 18. 选择题 | 详细信息 |
|
一定温度下,取pH=12的NaOH溶液和氨水各10 mL,分别用蒸馏水冲稀至1 L。关于稀释后的溶液的pH的说法正确的是 A.NaOH溶液的pH小于氨水的pH B.NaOH溶液的pH大于氨水的pH C.两溶液的pH相等 D.无法判别两溶液pH的相对大小 |
|
| 19. 选择题 | 详细信息 |
|
室温下某溶液中由水电离产生的c(H+)等于10-10mol·L-1,该溶液的溶质不可能是( ) A.NaHSO4 B.NaCl C.HCl D.Ba(OH)2 |
|
| 20. 选择题 | 详细信息 |
|
等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液滴加等浓度的盐酸将它们恰好中和,用去酸体积分别为V1、V2、V3,三者的大小关系正确是 A. V1=V2= V3 B. V1=V2﹤V3 C. V1<V2 = V3 D. V1=V2﹥V3 |
|
| 21. 实验题 | 详细信息 |
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。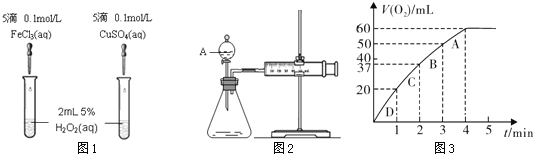 (1)定性如图1可通过观察_______,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是_______。 (2)定量如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_________。 (3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。 ①写出H2O2在二氧化锰作用下发生反应的化学方程式________________。 ②实验时放出气体的总体积是________mL。 ③A、B、C、D各点反应速率快慢的顺序为:___>___>___>___。 解释反应速率变化的原因___________________。 ④H2O2的初始物质的量浓度是___________(请保留两位有效数字)。 |
|
| 22. 综合题 | 详细信息 |
|
能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。 (1)已知:在25℃、101kPa下,1mol甲烷燃烧生成CO2和液态水时放热890.31kJ。请写出甲烷燃烧热的热化学方程式__________。 (2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g) 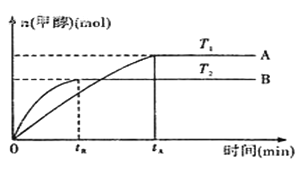 ①合成甲醇反应的△H__________(填“>”、“<”或“=”)0。 ②平衡常数的表达式为:__________。温度为T2时的平衡常数__________(填“>”、“<”或“=”)温度为T1时的平衡常数。 |
|
| 23. 填空题 | 详细信息 |
|
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇: CO(g) +2H2(g)   (1)图1是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=______。 (2)图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。 (3)恒容条件下,下列措施中能使 A.升高温度 B.充入He气 C.再充入2molCO和5molH2 D.使用催化剂 |
|
| 24. 填空题 | 详细信息 | |||||||||||||||||||||
在80℃时,将0.40 mol的四氧化二氮气体充入2 L的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
||||||||||||||||||||||
| 25. 填空题 | 详细信息 | ||||||||
下表是不同温度下水的离子积数据:
|
|||||||||



