2019届高三上半期11月月考理科综合化学在线测验完整版(黑龙江省大庆实验中学)
| 1. 选择题 | 详细信息 |
|
化学与生产、生活社会密切相关,下列有关说法正确的是 A. 用食醋浸泡有水垢(主要成分为CaCO3) 的水壶,可以清除其中的水垢,这是利用了醋酸的氧化性 B. 白居易在《问刘十九》中有“绿蚁新醅酒,红泥小火炉”诗句,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应 C. 地沟油在碱性条件下水解可以生成高级脂肪酸盐和甘油 D. 普通玻璃和氮化硅陶瓷都属于新型无机非金属材料 |
|
| 2. 选择题 | 详细信息 |
|
下列有关有机化合物的说法正确的是( ) A. “间二甲苯”中苯环上的一个氢原子被“-C2H3Cl2” 取代时,形成的同分异构体最多有9种 B. 将等物质的量的C2H 6与Cl2混合在光照条件下,充分反应可以制得纯净的氯乙烷 C. 苯与液溴混合后加入铁粉,此时苯发生了加成反应 D. 食物中的纤维素在人体内可以水解生成葡萄糖,为人类活动提供能量 |
|
| 3. 选择题 | 详细信息 |
|
阿伏加德罗常数的值为NA。下列说法正确的是 A. 标准状况下,22.4 L乙烷中所含的极性共价键数目为7NA B. 2.0 g H218O和D2O的混合物中含有质子数为NA C. 5.6 g Fe和足量盐酸完全反应,转移的电子数为0.3NA D. 2 L 0.05 mol·L−1乙醇溶液中含有H原子数目为0.6NA |
|
| 4. 选择题 | 详细信息 | ||||||||
W、X、Y、Z属于短周期元素,其性质或原子结构特点如下表,下列说法不正确的是
|
|||||||||
| 5. 选择题 | 详细信息 |
已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L−1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是 A. a点溶液的c(H+)=4×10-4mol·L-1 B. 水电离程度:e>d>c>b>a C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) D. d点:c(OH-)=c(CH3COOH)+c(H+) |
|
| 6. 选择题 | 详细信息 | |||||||||||||||
下列实验方案能达到实验目的的是
|
||||||||||||||||
| 7. 选择题 | 详细信息 |
钠熔融盐燃料电池拥有比锂电池高一倍的能量密度,在同等电池体积下,可让电动汽车行驶距离成倍提升。如图所示是某钠熔融盐燃料电池,其中生成物Y是一种氧化物。下列说法不正确的是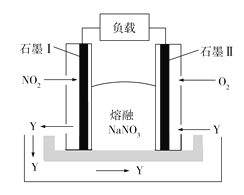 A. 电池工作时,石墨电极Ⅰ上电极反应式为2NO2 −2e− +O2− B. 电池工作时, C. 该电池充电时,石墨电极Ⅱ连接电源的负极 D. 电池工作时,外电路中流过1 mol电子,则消耗46 g NO2 |
|
| 8. 综合题 | 详细信息 |
|
CO2是造成温室效应的废气,研究二氧化碳的利用具有十分重要的意义。CO2可用来合成低碳烯烃:2CO2(g)+6H2(g) (1)已知:H2的燃烧热是285.8kJ/mol,且H2O(g) (2)图l、图2分别是CO2的平衡转化率(α)随压强及温度的变化关系,已知Z为起始时的投料比,即Z= 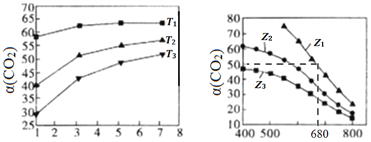 ①图l中投料比相同,温度从低到高的顺序为________。 ②图2中Z1、Z2、Z3投料比从大到小的顺序为________,理由是____________________。 ③若要进一步提高CO2的平衡转化率,除了可以适当改变反应温度外,还可以采取的措施有________________。(任写一种) (3)若图2中Z1=2.5,在温度为680 K、体积为2 L的恒容密闭容器中,充入1 mol H2和0.4 mol CO2,10 min后达到平衡状态。 ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=________。 ②680 K时,反应的平衡常数K=________。 (4)在催化剂M的作用下,CO2和H2同时发生下列两个反应: ①2CO2(g)+6H2(g) ②2CO2(g)+6H2(g) 下图是乙烯在相同时间内,不同温度下的产率,则高于T℃时乙烯产率降低的原因可能是______。  A.催化剂M的活性降低 B.①反应的平衡常数变大 C.②反应的活化能增大 D.生成甲醚的量增加 |
|
| 9. 实验题 | 详细信息 |
|
工业用氧化铝与焦炭在氮气流中加强热制备氮化铝(AlN),氮化铝样品中含少量Al4C3、C、Al2O3杂质。某实验小组拟测定ag氮化铝样品中Al4C3含量并探究甲烷与氧化铜反应的氧化产物为CO2。 已知:(Ⅰ) AlN、Al4C3都能与水反应,分别生成NH3、CH4。 (Ⅱ)CH4还原氧化铜:CH4+4CuO  (1)装置连接顺序为 ________________________(按气流从左至右)。 (2)写出A中发生反应的化学方程式:AlN和稀硫酸反应:__________________________;Al4C3与 稀硫酸反应:_______________________________________________________________________。 (3)有下列操作步骤: ①缓缓向A中通入一定量的N2。 ②称量B(酒精灯、木块和铁架台除外),按顺序组装仪器,检查装置的气密性,将样品放入烧瓶中; ③点燃B处酒精灯; ④再次称量B; ⑤从分液漏斗中缓慢滴入稀硫酸,直到不再产生气体为止; ⑥再次缓慢通入一定量的N2。 正确的操作顺序是_________________________;操作①的目的是_______________;若操作③与操作⑤顺序颠倒, 将导致测得的Al4C3的质量分数_________(填“偏大”“偏小”或“不变”)。 (4)设计实验证明A中有NH4+生成:__________________________________。 (5)实验结束后,测得B中固体质量减少bg,则样品中Al4C3的质量分数为________×100%。 (6)通过测定C中生成BaCO3的质量可以确定甲烷与氧化铜反应是否有CO生成。实验完毕后,测得B 中固体质量减少bg;对C中混合物进行过滤、洗涤、干燥、称重,当m(BaCO3)=________g时(用含b表达式表示),表明氧化产物只有CO2。 |
|
| 10. 综合题 | 详细信息 |
|
钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图: 已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O; ②25℃时,BaCO3的溶度积Ksp=2.58×10-9; (1)BaTiO3中Ti元素的化合价为:__________。 (2)用盐酸酸浸时发生反应的离子方程式为: __________。 (3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。 ①过滤操作中使用的玻璃仪器有_____________________。 ②如何证明晶体已洗净?_______________________。 (4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。 (5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。 (6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。 |
|
| 11. 综合题 | 详细信息 |
|
铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题: (1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。 (2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。 (3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。 (4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构为_______。 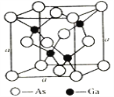 (5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。  ①与GaAs互为等电子体的一种原子晶体的化学式为________。 ②已知晶胞的密度是ρ g·cm−3,阿伏加德罗常数值为NA,棱长a=_____pm。 |
|
| 12. 推断题 | 详细信息 |
[化学-选修5:有机化学基础]有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示: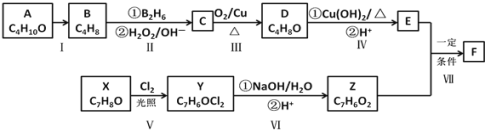 已知:①A的核磁共振氢谱图中显示两组峰②F的结构简式为:  ③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。 ④ 请回答下列问题: (1)A的名称为______________(系统命名法);Z中所含官能团的名称是___________。 (2)反应Ⅰ的反应条件是__________;反应Ⅲ的反应类型为__________ 。 (3)E的结构简式为_______________________。 (4)写出反应Ⅴ的化学方程式____________________________________________。 (5)写出反应IV中的化学方程式____________________________________________。 (6)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件: ①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有_________种(不包括立体异构),核磁共振氢谱有四组峰的结构为____________。 |
|
最近更新



