高二前半期期中考试化学网上检测无纸试卷带答案和解析(2018-2019年广西兴安县第三中学)
| 1. 选择题 | 详细信息 |
|
我国古代造纸工艺的部分过程如下,其中一定涉及化学变化的是 A.  水洗切料 B. 水洗切料 B. 加石灰水蒸煮 加石灰水蒸煮C.  捣烂打浆 D. 捣烂打浆 D. 成形晒干 成形晒干 |
|
| 2. 选择题 | 详细信息 |
|
属于有机高分子材料的是 A.聚乙烯 B.硅酸盐陶瓷 C.普通玻璃 D.水泥 |
|
| 3. 选择题 | 详细信息 |
|
手机芯片中的半导体材料所含主要元素为 A.碳 B.硅 C.磷 D.硫 |
|
| 4. 选择题 | 详细信息 |
|
下列生产过程一定用到蒸馏技术的是 A.炼钢 B.石料开采 C.木材加工 D.白酒生产 |
|
| 5. 选择题 | 详细信息 |
|
将化学能转化为电能的过程是 A.水力发电 B.风力发电 C.电池放电 D.太阳能发电 |
|
| 6. 选择题 | 详细信息 |
|
下列人类行为,会导致环境污染的是 A.植树造林 B.直接排放燃煤尾气 C.使用自行车出行 D.循环使用塑料袋 |
|
| 7. 选择题 | 详细信息 |
|
运输氢氧化钠的车辆上必须贴有的警示标志是 A.  B. B. C.  D. D. |
|
| 8. 选择题 | 详细信息 |
|
制出第一张元素周期表的科学家是 A.舍勒 B.道尔顿 C.门捷列夫 D.阿伏加德罗 |
|
| 9. 选择题 | 详细信息 |
关于如图所示原子结构示意图的说法正确的是 A.该原子带正电 B.核电荷数为17 C.核外电子层数为7 D.最外层电子数为2 |
|
| 10. 选择题 | 详细信息 |
|
从物质分类的视角看,下列物质中属于氧化物的是 A.Ba B.BaO C.Ba(OH)2 D.BaCO3 |
|
| 11. 选择题 | 详细信息 |
|
硫酸工业尾气不经处理直接排放,会导致酸雨,原因是该尾气中含有 A.O2 B.N2 C.H2O D.SO2 |
|
| 12. 选择题 | 详细信息 |
|
1 mol H2O中含有的水分子个数约为 A.3 B.18 C.6.02×1023 D.3×6.02×1023 |
|
| 13. 选择题 | 详细信息 |
|
胶体是一种分散系,胶体粒子的大小范围是 A.小于1 nm B.1~100 nm C.100~1000 nm D.大于1000 nm |
|
| 14. 选择题 | 详细信息 |
|
稀释浓硫酸的有关操作中,正确的是 A.  B. B. C.  D. D. |
|
| 15. 选择题 | 详细信息 |
|
在元素周期表中,金属性最强的短周期元素是 A.Mg B.F C.Na D.Cl |
|
| 16. 选择题 | 详细信息 |
|
烃是只含C、H两种元素的有机物。下列球棍模型中,可表示烃的是 A.  B. B. C. C. D. D.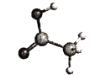 |
|
| 17. 选择题 | 详细信息 |
|
氯化钠在灼烧时会使火焰呈 A.红色 B.蓝色 C.绿色 D.黄色 |
|
| 18. 选择题 | 详细信息 |
|
碳酸钠俗名纯碱,也叫苏打。室温下,一定浓度碳酸钠溶液的pH范围不可能是 A.3~5 B.8~9 C.9~10 D.10~11 |
|
| 19. 选择题 | 详细信息 |
|
我国从2000年起就逐渐用新型消毒剂取代氯气对生活饮用水进行消毒,该新型消毒剂的主要成分是 A.HCl B.CaCO3 C.NaCl D.ClO2 |
|
| 20. 选择题 | 详细信息 |
|
在冶金工业中,可采用氢氧化钠沉淀法处理废水中的铜离子,这是因为该处理过程中产生的氢氧化铜 A.易分解 B.具有氧化性 C.难溶于水 D.颜色为蓝色 |
|
| 21. 选择题 | 详细信息 |
|
既能与稀盐酸又能与氢氧化钠溶液反应的物质是 A.MgO B.MnO2 C.FeO D.Al2O3 |
|
| 22. 选择题 | 详细信息 |
|
“航天金属”钛在工业上用钠与四氯化钛来制备:TiCl4 + 4Na A.只作氧化剂 B.只作还原剂 C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂 |
|
| 23. 选择题 | 详细信息 |
|
下列有机物结构式中的碳原子均为“饱和”的是 A.  B. B.C.  |
|
| 24. 选择题 | 详细信息 |
|
配制100 mL 1.00 mol / L NaCl溶液的过程中,“定容”操作正确的是 A.  B. B. C. C.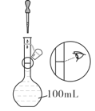 D. D. |
|
| 25. 选择题 | 详细信息 |
|
2016年11月3日,我国成功发射了以液氢、液氧为推进剂的长征五号大型运载火箭(亦称为“冰箭”),达到国际先进水平,标志着我国由航天大国进入航天强国行列。有关该火箭推进剂的说法错误的是 A.温度低 B.燃烧效率高 C.反应产物有污染 D.贮存难度大 |
|
| 26. 选择题 | 详细信息 |
|
有关钙的化合物的反应中,属于吸热反应的是 A.CaCO3 C.Ca(OH)2 + 2HCl = CaCl2 + 2H2O D.Ca(OH)2 + CO2 = CaCO3↓+ H2O |
|
| 27. 选择题 | 详细信息 |
|
下列电子式所表示的化合物中,含有共价键的是 A. |
|
| 28. 选择题 | 详细信息 |
|
如图所示的注射器中放入一小片铜,吸入适量的浓硝酸并密封注射器口,可观察到注射器内有气体产生,该气体的颜色为 A.紫色 B.蓝色 C.绿色 D.红棕色 |
|
| 29. 选择题 | 详细信息 |
|
漂白粉若保存不当,其有效成分次氯酸钙很容易失效,反应原理为:Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HClO,2HClO A.密闭 B.高温 C.避光 D.干燥 |
|
| 30. 选择题 | 详细信息 |
|
某同学将锌与硝酸银溶液反应的离子方程式写为:Zn + Ag+ = Zn2+ + Ag,该离子方程式的书写错误之处是 A.产物判断错误 B.未标沉淀符号 C.电荷不守恒 D.质量不守恒 |
|
| 31. 填空题 | 详细信息 |
|
元素在周期表中的位置反映了元素的原子结构和性质。请回答下列有关硼(B)元素的问题: (1) (2)铝元素在元素周期表中的位置为第三周期第IIIA族,硼元素在元素周期表中的位置为___________。 (3) (4)硼元素的最高价氧化物对应的水化物酸性比氮元素的最高价氧化物对应的水化物酸性_______(填“强”或“弱”)。 |
|
| 32. 填空题 | 详细信息 |
|
2016年6月英国《自然 • 化学》杂志报道了一种结构新奇的含铍(Be)化合物,该化合物的化学式为BeL2,其中L是一个有机物分子,化合价为0。 (1)化合物BeL2中铍元素的化合价为_______。 (2)在一定条件下,BeLCl2、金属钾(K)和有机物L反应生成BeL2和KCl,该反应的化学方程式为________________。 |
|
| 33. 填空题 | 详细信息 |
|
甲烷、乙醇均为重要的化工原料和燃料。请回答下列问题: (1)甲烷在催化剂作用下可被氧化为甲醇(CH3OH),其化学方程式为: 2CH4 + O2 (2)光照条件下,甲烷与足量的氯气反应可得到CCl4,其反应类型为_______。 (3)乙醇在氧气不足的环境中燃烧,其产物除CO2、H2O和C外还可能有_____。 |
|
| 34. 实验题 | 详细信息 | ||||||
|
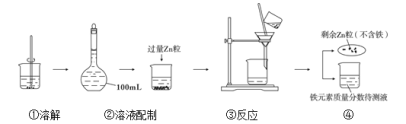
我国是世界上缺铁性贫血发生率较高的国家之一,食用含铁丰富的食物或口服补铁剂可以补充铁。葡萄糖酸亚铁(C12H22O14Fe)是一种常用的补铁剂,其铁元素和三价铁质量分数的国家标准如下表所示。 葡萄糖酸亚铁补铁剂国家标准(部分)
|
|||||||
| 35. | 详细信息 |
|
壳聚糖[(C6H11O4N)n]具有无毒、抑菌、生物相容性好等特点,被广泛应用于食品、医药、化妆品、农业和环保等领域。请回答以下问题: (1)壳聚糖在组成上比淀粉[(C6H10O5)n]多一种化学元素,该元素是________;在结构上与淀粉相似,都属于动植物基本营养物质中的________类。 (2)壳聚糖因含氨基而显碱性,所以壳聚糖具有_____(填“镇痛”或“抗酸”)作用,氨基的结构简式为______。 (3)在废水处理工艺中,壳聚糖可作为絮凝剂和吸附剂,但残留在水中的壳聚糖会引发水体污染,这种水体污染的主要现象为__________,因此壳聚糖_______(填“属于”或“不属于”)绿色废水处理材料。 (4)壳聚糖的最终水解产物可用于预防和治疗关节炎。壳聚糖在稀硫酸中的水解产物为硫酸氨基葡萄糖[(C6H11O5NH3)2SO4],同理,其在稀盐酸中的水解产物为________。氨基葡萄糖和葡萄糖一样,均能与银氨溶液发生________反应。 (5)壳聚糖可从虾壳或蟹壳中提取,属于________(填“天然”或“合成”)高分子化合物。适量摄入壳聚糖对人体有益,但过量摄入会影响人体对维生素的吸收,由此可见,科学的饮食观念是_____________。 |
|
最近更新