江苏省南通市海门中学2021届高三12月考试化学题免费在线检测
| 1. 选择题 | 详细信息 |
|
化学与生产、生活及环境密切相关,下列说法不正确的是 A.纳米铁粉可以去除被污染水体中的Cu2+、Hg2+等重金属离子 B.酒精和84消毒液混合使用能提高对新型冠状病毒的预防效果 C.葡萄酒中通常含有微量SO2,既可以杀菌又可以防止营养成分被氧化 D.燃煤中加入CaO可以减少酸雨的形成,但不能减少温室气体的排放 |
|
| 2. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是 A.通入大量二氧化碳的溶液:K+、Ca2+、Cl-、NO B.能使紫色石蕊试液变蓝的溶液:Na+、NH C.含有硝酸钠的溶液:H+、Mg2+、I-、SO D.室温下,c(OH-)/c(H+)=1×10-12 mol/L的溶液:K+、Fe3+、SO |
|
| 3. 选择题 | 详细信息 |
下列实验装置能达到相应目的的是 A.用图甲装置制备Cl2 B.用图乙装置稀释浓硫酸 C.用图丙装置制备CO2 D.用图丁装置灼烧碳酸氢钠制碳酸钠 |
|
| 4. 选择题 | 详细信息 |
|
下列离子方程式正确的是 A.氯气与水的反应:Cl2+H2O=2H++Cl-+ClO- B.工业上用铜电极电解饱和食盐水制备氯气:2Cl-+2H2O C.次氯酸钠溶液与氢碘酸混合:2ClO-+2H2O+2I-=I2+Cl2↑+4OH- D.将足量的氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- |
|
| 5. 选择题 | 详细信息 |
据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示。下列说法正确的是 A.图中 B.步骤ⅲ、ⅳ的总反应方程式是CH3OH+H2O2 C.步骤ⅰ到ⅳ中消耗的CH4与H2O2的物质的量之比为1:1 D.根据以上原理,步骤ⅵ生成CO2和H2O |
|
| 6. 选择题 | 详细信息 |
臭氧层中臭氧分解过程如图所示,下列说法正确的是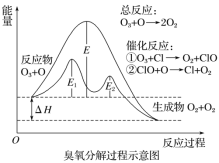 A.催化反应①②均为放热反应 B.E1是催化反应①对应的正反应的活化能,(E2+ΔH)是催化反应②对应的逆反应的活化能。 C.决定O3分解反应速率的是催化反应②。 D.温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大。 |
|
| 7. 选择题 | 详细信息 |
某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示: 已知: 根据以上工艺流程,下列说法不正确的是 A.为实现溶液C到溶液D的转化,加入过量 B.溶液E和碳酸钠混合方式不同对产品的成分没有影响 C.在制备产品时,溶液D中不直接加入 D.蒸氨过程发生总反应的化学方程式为: |
|
| 8. 选择题 | 详细信息 |
间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列有关说法正确的是 A.电极Ⅰ的材料可用石墨、铜等导电材料替换 B.H+由电极Ⅰ区域移向电极Ⅱ区域 C.电极Ⅰ的电极反应式为:2 D.常温常压下,每生成2.24L O2可处理NO 0.2 mol |
|
| 9. 选择题 | 详细信息 |
化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关化合物甲、乙的说法正确的是 A.甲分子中所有碳原子一定处于同一平面 B.乙中含有2个手性碳原子 C.用NaHCO3溶液或FeCl3溶液不能鉴别化合物甲、乙 D.乙能与盐酸、NaOH溶液反应,且1 mol乙最多能与4mol NaOH反应 |
|
| 10. 选择题 | 详细信息 | ||||||||||||||||||||
根据下列实验操作和现象所得到的结论正确的是
|
|||||||||||||||||||||
| 11. 选择题 | 详细信息 |
常温下,向1L 1.0mol/L的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。 下列说法正确的是 A.常温下,HClO电离平衡常数的数量级为10-8 B.a点溶液中存在 4c(Cl-)=c(HClO)+c(ClO-) C.b点溶液中存在c(Na+)>c(SO D.c点溶液中c(H+)=1.5mol/L |
|
| 12. 选择题 | 详细信息 | |||||||||||||||||||||
温度为T1时,在容积为2 L的恒容密闭容器中发生反应:2NO(g)+O2 (g)
下列说法正确的是 |
||||||||||||||||||||||
| 13. | 详细信息 |
|
乙二胺四乙酸二钠盐是配合剂的代表性物质,能和碱金属、稀土元素和过渡金属等形成稳定的水溶性络合物,广泛应用于高分子化学工业、日用化学工业、医药工业试剂。乙二胺四乙酸根可以和三价铬离子1∶1形成六配位离子。乙二胺四乙酸结构简式为: 请回答下列问题: (1)写出基态金属铬原子核外的价电子排布式___________。 (2)乙二胺四乙酸根离子和三价铬离子形成的六配位离子中,配位原子为___________。 (3)乙二胺四乙酸分子中,碳原子的杂化方式为___________,其分子中含有的四种非金属元素的电负性由大到小顺序为___________。 (4)0.5 mol的乙二胺四乙酸分子中含有的σ键数目为___________。 (5)常温下,乙二胺四乙酸在水中溶解度较小。但常温下乙酸却易溶于水,试解释乙酸易溶于水的原因是:___________。 (6)金属铬可形成正盐亚铬酸钴,该盐晶体的晶胞沿y轴一个方向的投影如下图所示。晶胞中Co、Cr、O分别处于晶胞的顶角、体心和面心位置。则该盐的化学式为___________。  |
|
| 14. | 详细信息 |
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池、医药工业、催化行业以及印染工业等行业中。由一种废料(主要成分是铁镍合金,还含有铜、镁、硅的氧化物)为原料制取NiSO4·6H2O步骤如下: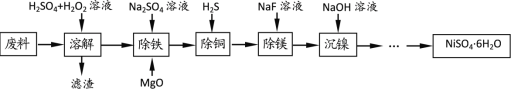 已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价; ②常温下Ksp(MgF2)=6.4×10-9, Ka(HF)=6.3×10-4; (1)“溶解”时加入H2O2溶液的目的是___________。 (2)“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出其离子方程式___________。 (3)向“除铜”后的滤液中加入NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液的pH偏低,将会导致MgF2沉淀不完全,其原因是___________。 (4)“沉镍”后所得滤液中,可循环使用的主要溶质为___________(填化学式)。 (5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的化学方程式为___________。 (6)在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是___________。 |
|
| 15. 实验题 | 详细信息 |
|
三氯化铬(CrCl3)是化学合成中的常见物质,工业上用铬酸钠(Na2CrO4)来制备。 Ⅰ.制备三氯化铬 某兴趣小组用实验室中的红矾钠(Na2Cr2O7)为原料来制备CrCl3.流程如下:  已知:a.CrCl3·6H2O不溶于乙醚,易溶于水、乙醇、易水解。 b.CrCl3·6H2O易升华,在高温下能被氧化。 (1) 步骤Ⅰ中“加入40%NaOH”的目的是___________。步骤Ⅰ中“加CH3OH与10%HCl”中甲醇作为还原剂,反应后生成CO2,请写出反应的离子方程式:___________。 (2) 步骤Ⅲ,请补充完整由步骤Ⅱ得到的固体Cr(OH)3经多步操作制备CrCl3·6H2O的实验操作:___________。(实验中须使用的:6.0mol/L盐酸、乙醚、减压干燥器) Ⅱ.测定三氯化铬质量分数 称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L-1H2SO4至溶液呈强酸性,此时铬以Cr2O (1)加入Na2O2后要加热煮沸,其主要原因是:___________。 (2)若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果___________(填“偏高”、“偏低”或“无影响”)。 (3)计算样品中无水三氯化铬的质量分数_________。(写出计算过程) |
|
| 16. | 详细信息 |
|
选择性催化还原法(SCR)工艺是目前应用最广泛的脱硝技术,该工艺原理是以NH3 为还原剂,在催化剂作用下选择性地与 NOx发生氧化还原反应生成无害化的H2O和N2。 (1)反应原理如图1所示: 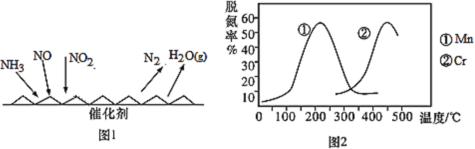 ①已知:4NH3(g)+5O2(g)═ 4NO(g)+6H2O(g) △H1= a kJ/mol N2(g)+ O2(g)═ 2NO(g) △H2 = b kJ/mol 则NH3与NO反应的热化学方程式为:___________。 ②图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为:___________。 ③实验室进行模拟工业合成氨时,将2.5 mol N2和3.5 mol H2的混合气体通入某密闭反应器,在温度t℃、压强 p0 pa 条件下进行反应。平衡时,测得容器内混合气体的物质的量为5.0 mol,则该温度下的平衡常数Kp =___________ pa-2.(以分压表示,分压=总压×物质的量分数) (2)空速代表单位时间内单位体积催化剂处理烟气量,即空速越大催化剂处理烟气量越大。在烟气温度为165℃时,空速对催化剂脱硝效率影响结果如图3所示。脱硝率随空速增大而减小的可能原因是___________。 (3)氨氮比作为SCR脱硝反应重要参数之一,在反应过程中,其数值需要严格把控。若喷氨量不足,NOx反应不完全,脱硝效率低;若喷氨量过剩,未反应的NH3导致氨逃逸,将会增加运行成本,且引起二次污染。在空速为2000h-1、烟气温度为165°C下,考察氨氮比对催化剂脱硝率的影响,由图4可知,氨氮最佳比为___________。  (4)催化剂Mn的纯度对该脱硝反应具有决定性的影响。目前主要采用单膜双室电积工艺,在MnSO4+(NH4)2SO4电解液体系中电沉积金属锰,同时阳极联产MnO2并富集回收硫酸。  ①该电解装置中的交换膜为___________交换膜 (选填“阳离子”或“阴离子”) ②阳极区的主要电极反应方程式为: ___________。 |
|
| 17. | 详细信息 |
化合物H是一种治疗失眠症的药物,其一种合成路线如下: 已知:①—NH2易被氧化; ② (1)化合物H中所含官能团的名称为___________。 (2)E→F的化学反应类型为___________反应。 (3)化合物B的结构简式为___________。 (4)D的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___________。 ①分子中有4种不同化学环境的氢原子; ②能发生水解反应,水解所得两种等物质的量的产物分别与足量溴水反应消耗的Br2相等。 (5)写出以  和(EtO)2POCH2CN为原料制备 和(EtO)2POCH2CN为原料制备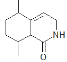 的合成路线流程图___________ (无机试剂和有机溶剂任用,合成路线例见本题题干)。 的合成路线流程图___________ (无机试剂和有机溶剂任用,合成路线例见本题题干)。 |
|
最近更新



